Az Eurostat legutóbbi adatai szerint 2013-ban az összes halálozás 26 százalékáért a rosszindulatú daganatok voltak a felelősek. Becslések szerint 15–20 év múlva csaknem megkétszereződik Európában a rákban elhunytak száma. Mátés Lajos, az MTA Szegedi Biológiai Kutatóközpont Genetikai Intézetében, a Tumor Genom Kutató Csoport vezetőjeként 2011 óta foglalkozik génterápiás eljárások fejlesztésével és a rák kialakulásának genetikai okaival. A szegedi egyetemen diplomázott biológus hat év berlini kutatómunka után tért vissza a Tisza-parti városba, ahol immár az MTA Lendület programjának nyerteseként dolgozik.

– Úgy terjedt el a köztudatban, hogy a rák genetikai betegség: ha valakinek a családjában előfordult, úgy hisszük, szinte borítékolható, hogy az utódok sem kerülhetik el, bármit tesznek is. Gyakran érvelnek a laikusok a keményen dohányzó, a whiskyt sem megvető, hosszú életű Churchill példájával. Mi a tudományos igazság?
– Kétségtelen, hogy a rákot genomunk betegségének tekinthetjük. Kialakulása sejtjeink örökítőanyagában, a DNS-ben bekövetkező változásokhoz – mutációkhoz – köthető. Más ismert genetikai betegségekkel ellentétben azonban, amilyen például az örökletes vérzékenység, ezek a mutációk nagyrészt nem öröklöttek, hanem az egyén élete során alakulnak ki, és nemcsak egy bizonyos gént, hanem több gént is érintenek. Különböző daganatokat összehasonlítva a mutációk által érintett gének sora is gyakran különböző. Bizonyos öröklött genetikai tényezők valóban emelhetik a rákbetegség kialakulásának esélyét. Az egyik legismertebb példa erre a BRCA1 gén mutációja, amelynek megállapítására genetikai szűrővizsgálat is a rendelkezésünkre áll. Egy adott családban öröklődő BRCA1-mutáció valódi hatása a rák kialakulási valószínűségére azonban más gének közreműködésétől és életmódbeli tényezőktől is függ. Tehát egyes családoknál komolyabban megemelheti ez a mutáció a rák kialakulásának kockázatát, mint másoknál. Ezért a mutáció jelenléte az egyén szintjén az adott család kórtörténetével együtt értékelve ad igazán megbízható előrejelzést a rák kialakulási valószínűségéről. Így volt ez Angelina Jolie, a híres hollywoodi színésznő esetében is, aki amellett, hogy BRCA1-mutáció hordozó, három közeli rokonát, köztük édesanyját is, elveszítette rákos megbetegedés következtében. Ezért döntött a rákmegelőző műtéti beavatkozások mellett.
– Egészségnevelők, orvosok mégis gyakran figyelmeztetnek bennünket arra, hogy az életmódbeli tényezők komolyan emelhetik a rák kockázatát.
– Az egyik legismertebb ilyen tényező a dohányzás. A dohányfüstben jelenlévő egyes anyagok képesek új, nem öröklött, mutációk előidézésére, amelyeknek egy része az említett BRCA1-mutációhoz hasonlóan elősegítheti a rák kifejlődését. Természetesen ezeknek az anyagoknak sem egyforma a hatása minden emberre. Egyesek szervezete jobb, míg másoké rosszabb hatékonysággal javítja ki a dohányfüst komponensei által előidézett DNS-mutációkat. Mondanom sem kell, hogy az utóbbi, a DNS mutációit rosszabb hatásfokkal javító csoportba tartozó dohányosoknak jóval nagyobb az esélyük a dohányzás következtében kialalkuló tüdőrákra. Churchill valószínűleg az első csoportba tartozott, olyan öröklött genetikai adottságokkal rendelkezett, amelyek szerencsésen megvédték őt a dohányzás káros következményeitől.

Laboratóriumi egértörzs két színváltozata
– Ezek szerint mégiscsak van egy velünk született genetikai örökségünk, amely miatt vagy beindul, vagy nem szervezetünkben egy pusztító folyamat. Mitől függ ez?
– A rák kialakulásának evolúciós elmélete szerint a rákos sejtekben lépésről-lépésre felhalmozódó mutációk elősegítik olyan képességek kifejlődését, amelyek lehetővé teszik a mutáns sejtek szervezeten belüli túlélését és öncélú szaporodását. Ilyen képességek például a folyamatos sejtosztódás vagy az immunrendszer támadásának elkerülése. Egyetlen rákos folyamatot elősegítő mutáció jelenléte nem elégséges a betegség azonnali kialakulásához. Az örökletes BRCA1-mutáció hosszabb távon rákot indukáló hatása például éppen abban áll, hogy erősen fokozza további mutációk kialakulásának valószínűségét. E további mutációk hatása egymással összeadódva a sejteket alaposan eltorzítja az eredeti testi sejthez képest amelyből származnak, és lehetővé teszi a rákos sejtekre jellemző tulajdonságok kifejlődését.
– Akkor a rákos megbetegedések hátterében az öröklött hajlamosító mutációk, és olyan DNS-károsodást okozó életmódbeli tényezők állnak mint például a dohányzás?
– Valójában a rákos betegek legnagyobb részénél sem öröklött rákra hajlamosító mutáció, sem pedig direkt DNS-károsodást okozó életmódbeli tényező jelenléte nem mutatható ki. Így az esetek nagy részénél a rosszindulatú folyamat beindulását a szerencsétlen véletlennek tudjuk be. A legújabb kutatási eredmények azonban környezetünk eddig feltáratlan tényezőinek fontos szerepére hívják fel a figyelmet. Egy ötvenezer skandináv ikerpárt bevonó tanulmány eredményei azt igazolják, hogy a legtöbb daganattípus kialakulását bizonyos eddig feltáratlan környezeti tényezők segítik elő.
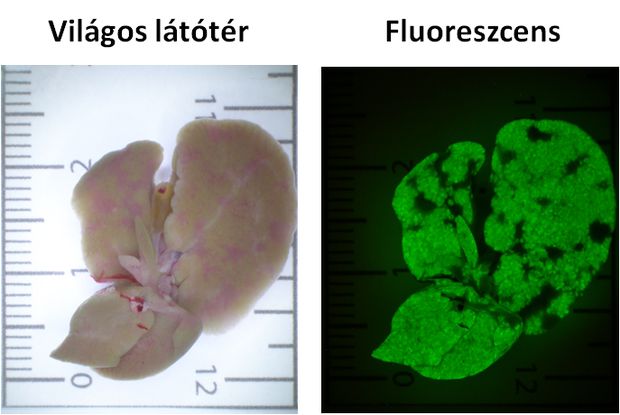
Kísérleti egér májába kívülről bejuttatott zöld fluoreszcens fehérjét (GFP) kódoló gén működésének kimutatása kék gerjesztőfénnyel való megvilágítással (fluoreszcens kép)
Hogy környezeti hatásra egy egérszerű ősi emlősállatból például elefánt jöjjön létre, évmilliókra volt szükség: kromoszómák átrendeződése, gének, géndarabok elvesztése vagy kettőződése és sorozatos mutációja kellett, hogy lejátszódjon. A legapróbb változások is csak nagyon lassan, az utódok egy újabb generációjában állhattak elő. A rák kialakulása során is egy hasonló evolúciós folyamat játszódik le egy testi sejtből kiindulva, de ennél sokkal gyorsabban. A folyamat gyorsaságának több oka is van. A rákos sejtek testi sejtekből való kialakulásához lényegesen kevesebb genetikai változásra van szükség mint egy új állatfaj létrejöttéhez. Továbbá a rákos sejtek generációs ideje a fajok evolúciójánál tapasztaltnál sokkal rövidebb, akár naponta is osztódhatnak, és jellemző rájuk a genetikai instabilitás, azaz nagyon gyakran keletkeznek bennük új mutációk.
– Hogyan képzeljük el az ilyen folyamatokat vizsgáló laboratóriumi kutatásokat? Mérgekkel bombázzák a sejteket?
– Direkt DNS-károsító mérgekre nincs szükség. Említettem, hogy az ilyen kockázati tényezőket, mint például a dohányzás, nem is lehet megtalálni a rákbetegek nagy részénél. Önmagukban nem DNS-károsító környezeti hatások is előidézhetik annak az általunk vizsgált „ugráló génnek” az aktiválódását, amelynek génállományunkon belüli mozgása mutációkat okozhat. Ez az „ugráló gén” az L1 retrotranszpozon, génállományunk parazitája, amely körülbelül 70 millió éve került be az ősi emlősökbe. Pusztán öncélúnak és károsnak tűnő „ugrálása” az emlősök evolúcióját is segítette, mivel az ugrálás melléktermékeként gyakran géneket és géndarabokat kettőzött meg. Az ember génállományának ma 17 százalékát teszi ki az évmilliók során benne felszaporodott mintegy 500 000 darab L1-retrotranszpozon. Az L1-rendszert ma egy az emlősök által „háziasított”, az evolúciót gyorsító genetikai eszközként foghatjuk fel, amelynek aktivitását gazdaszervezet többnyire szilárdan kontroll alatt tartja. Enyhe aktivitása kimutatható az emlősök és az ember ivarsejtjeiben, ezáltal a darwini evolúciót gyorsítja, de a testi sejtekben normális körülmények között nem aktív. Az utóbbi néhány évben kiderült, hogy a tumorok több mint a felében viszont kimutatható az L1 retrotranszpozon-rendszer működése, így joggal feltételezzük, hogy a klasszikus darwini evolúció mellett kóros esetben elősegítheti a testen belüli tumorevolúciót is. Az utóbbi időben fény derült arra is, hogy az L1 retrotranszpozon-rendszer laboratóriumi körülmények között aktiválható különféle környezeti stresszhatásokkal, miáltal a gazdasejt génállományában mutációkat hoz létre. Ez lehet a hiányzó láncszem: egy olyan rendszer, amely genetikai változásokat idéz elő környezeti hatások egy szélesebb skálájára reagálva. Laboratóriumunkban egy olyan technológiát fejlesztettünk ki, amellyel képesek vagyunk egerek májsejtjeit genetikailag módosítani, és ennek segítségével befolyásolni ezen rendszer működését. Jelenlegi feladataink közé tartozik annak feltárása, hogy milyen környezeti tényezők képesek kiváltani aktivitását az emlősök testi sejtjeiben, illetve az L1-aktivitás rákkeltő hatásának bizonyítása. Ha igazolható, hogy az L1-retrotranszpozon fontos résztvevője a rákos folyamatoknak, induktora a betegség kialakulásának, akkor mind megelőzésre, mind a betegség kezelésére is alkalmas új gyógyszerek kifejlesztésére nyílik majd lehetőségünk.
CHIKÁN ÁGNES
2016/30





