Sokat hallunk manapság a génterápiáról, arról, hogy mekkora távlatokat nyithat a különböző, eddig nehezen van egyáltalán nem gyógyítható betegségek elleni küzdelemben. Az már kevésbé közismert, hogy mi is tartozik szorosan ebbe a területbe, milyen lehetőségek és célok állnak a kutatók előtt, akik a génterápiával foglalkoznak. Egy magyar kutatóintézetben a központi idegrendszert károsító betegségekkel kapcsolatban foglalkoznak ilyen módszerekkel – igen ígéretes eredményekkel!
A központi idegrendszert érintő neurodegeneratív betegségek megismerése, az alapkutatási kérdések megválaszolásától kezdve a különböző diagnosztikai és terápiás, köztük génterápiás módszerek kidolgozásán keresztül azok lehetséges alkalmazásáig – ezek kiemelt célok a BrainVisionCenter Kutatóintézet és Kompetenciaközpontban. Az egyes betegségek génterápiás módszerrel történő kezeléséig azonban hosszú, kihívásokkal gazdagon tarkított út vezet.
Trükkös csomagolások
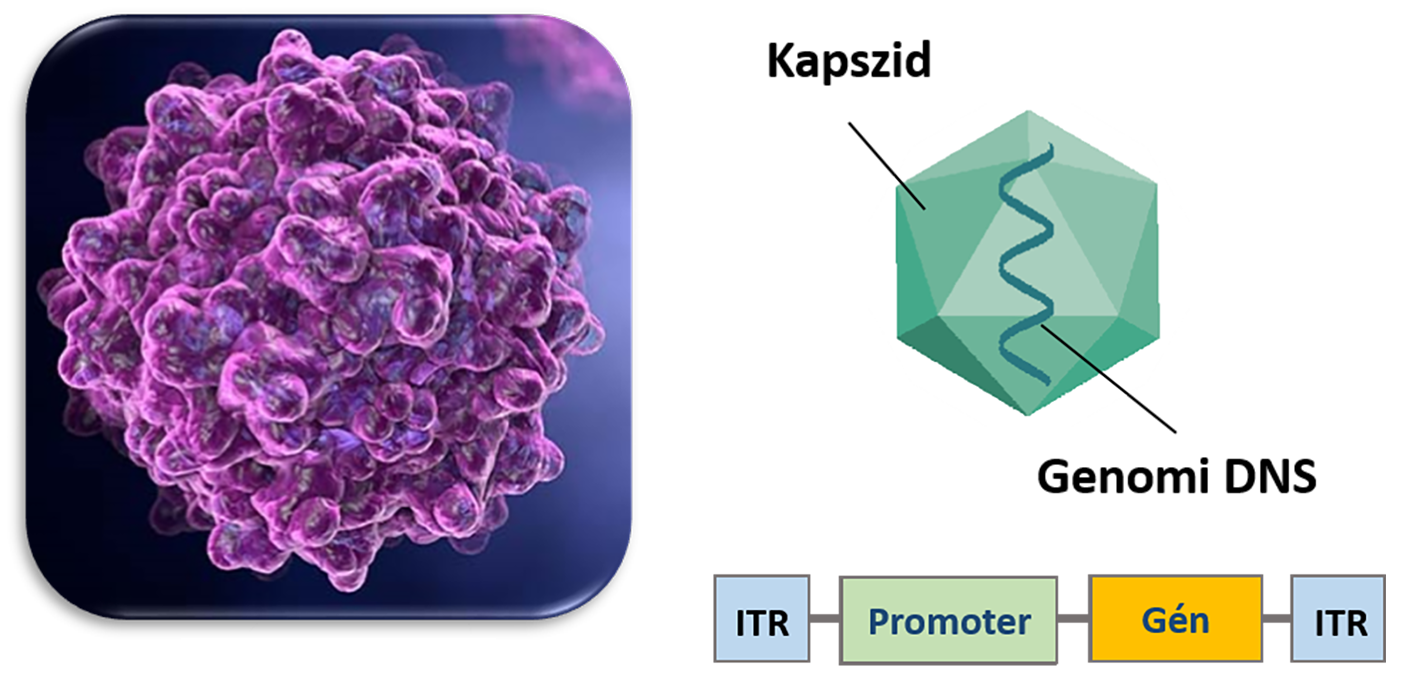
Génterápiának azt nevezzük, amikor egy hibás, funkcióját vesztett, vagy működését korlátozottan ellátni képes fehérjét „javítunk meg” az emberi szervezeten belül egy szövetben vagy egy bizonyos sejtpopulációban. Jellemzően ezt a műveletet a kérdéses fehérjét kódoló nukleinsav (leggyakrabban) DNS célsejtbe történő juttatásával végezzük el, ezzel rávesszük a sejtet arra, hogy a helyes működésű fehérje előállítását már ő maga végezze el. Génterápiás beavatkozást általában igen súlyos betegségek esetén eszközölnek, és etikai megfontolásból csak a beteg saját felnőtt sejtjein kivitelezhető. Csíravonal-terápia (ivarsejteket érintő változtatás) jelenleg nem megengedett, hiszen etikai korlátokba ütközik. Alapkutatási kérdéskörbe tartozik, hogy meghatározzuk, az adott fenotípusos elváltozás (egy betegség szemmel látható tünetei) mögött pontosan melyik sejtpopuláció hibája áll, tehát mely sejteket, és milyen eszköz segítségével kell megcéloznunk.
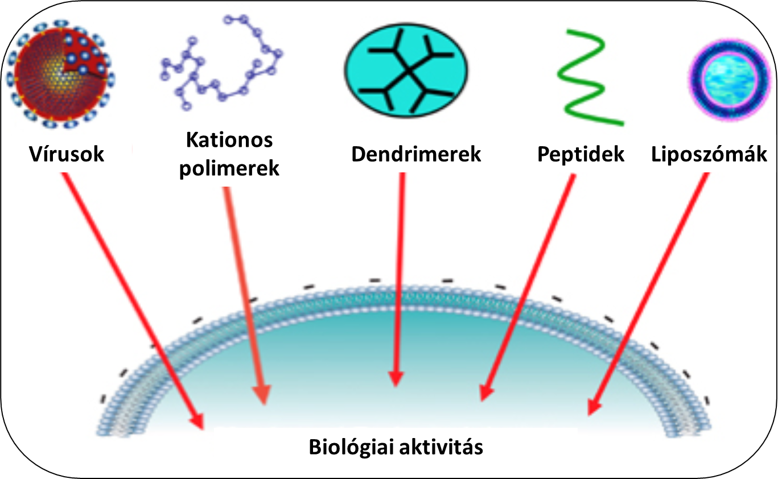
A feladat során komoly kihívásokkal nézünk szembe, ugyanis – a betegség típusától függően – különböző mechanikai és immunológiai gátakat kell leküzdenünk az emberi szervezeten belül. Gondoljunk például a vér-agy gátra, amely a központi idegrendszert óvja a keringésben található – az agyszövetre tekintve – káros hatásoktól, sajátos immunológiai védelmet is biztosítva számára. Az ezen akadályokon történő áthatolás nem lehetséges azáltal, ha egyszerűen a „csupasz” DNS-molekulát próbáljuk bejuttatni, minden esetben valamilyen „csomagolóanyagra” van szükség. Ezeket a segédeszközöket nevezzük vektoroknak. Sok esetben az erősen negatív töltésű molekulát valamilyen pozitív töltésű polimerhez (pl. dendrimer) kötve, vagy a sejtmembránhoz hasonló felépítésű apoláris „zsírcseppecskékbe” (liposzómákba) csomagolva próbáljuk meg bejuttatni a sejtekbe. A központi idegrendszer hálózatát felépítő sejtek célzására a leghatékonyabb eszközök – jelen ismereteink szerint – a virális vektorok, ugyanis a vírusok fehérjeburkolatát alkotó kapszidok segítségével is lehetséges a szövetspecifikus célzás. Az egyes szövetet alkotó sejtek felszínén egyedi receptormintázat fejeződik ki, amelyekhez a víruspartikulumok a kapszidfehérjéik segítségével kap-csolódnak. Ezt a receptorkötést úgy a legkönnyebb elképzelni, mint egyedi zárakat a sejtek felszínén, amelyekhez a megfelelő kulcsokat próbáljuk megtalálni a vírusok kapszidfehérjéinek formájában, akár azok molekuláris újratervezésével is. Az adott szövet sejtjeihez illeszkedő kulcsok segítségével a vírusok tehát receptorközvetített módon képesek a sejt belsejébe jutni, ahol az általuk szállított genetikai információ alapján képesek kifejezni a korábban beléjük kódolt terápiás fehérjét.
Segítenek a vírusok
Két fő alkalmazási területet különböztetünk meg a virális alapú génterápiák esetén. Az úgynevezett ex vivo alkalmazás azt jelenti, hogy a páciensből kinyert testi sejtek genetikai állományát módosítjuk a megfelelő vírusvektorral, majd visszaültetjük a már egészséges sejteket. Ebben az esetben tehát egy klasszikus sejtterápiával kombinált génterápiás eljárásról beszélhetünk, erre jó gyakorlati példa a béta-thalassemia betegség jelenleg alkalmazott egyik kezelési módja. Az ilyen betegségben szenvedők vörösvértestjeiben a hemoglobin béta-láncainak szintézise elégtelen vagy teljesen hiányzik. Ez súlyos vérszegénységhez vezethet, amelynek következtében a betegek állandó vérátömlesztést igényelnek, ami jelentős életminőség-romlást jelent. Ma már létező megoldás, hogy a hibás vérképző őssejtek betegből történő begyűjtését követően, a sejtek genetikai állományába be-épülni képes lentivírus – amely a rettegett vad típusú HIV-1 vírus genetikailag módosított rekombináns változata – segítségével a sejtek saját DNS-ébe juttatják a béta-globin gén helyes kópiáját, majd az így felvértezett sejtet ültetik vissza a páciensekbe. A helyreállított sejtekből egészséges, eredeti funkciójukat ellátni képes vörösvértestek képződnek.
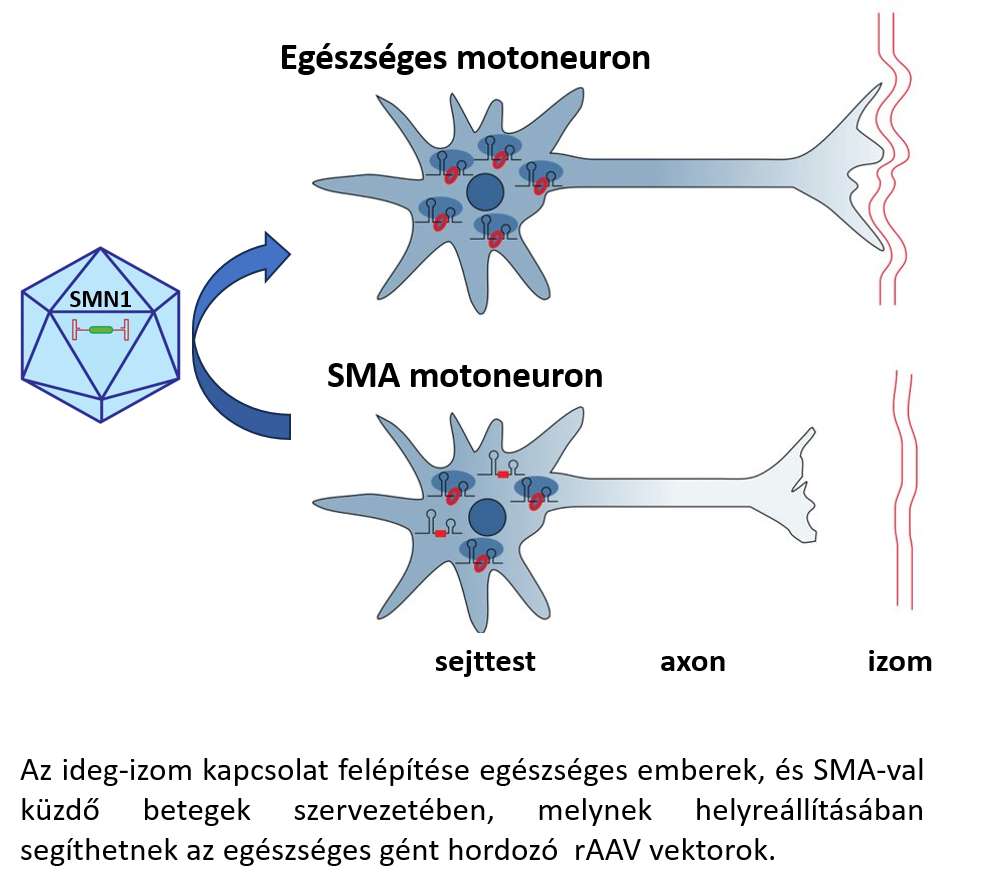
Az in vivo génterápia alkalmazása során nem távolítanak el sejteket a szervezetből, hanem közvetlenül a célzott szövetbe (pl. agyszövet) injektálják, vagy intravénásan fecskendezik be a virális vektort, amelyet így a véráram szállít el az alkalmazási területre. Társadalmunkban minden tízezredik embert érintő ritka genetikai betegség a gerincvelői izomsorvadás (Spinal Muscular Atrophy, SMA), amelyet a gerincvelői mozgatóneuronokban található SMN1 gén hibája okoz. Az SMN1 gén által kódolt SMN fehérje esszenciális az idegsejtek túléléséhez és az ideg-izom kapcsolatok kialakulásához, ami a mozgatóizmok és idegsejtek közötti kapcsolatot jelenti. A hibás SMN fehérje okozta neuronelhalás ezen kapcsolatok szétesését, közvetve a mozgatóizmok visszafordíthatatlan elsorvadását okozza megfelelő ingerületátvitel hiányában. Mindez a létfenntartáshoz elengedhetetlen (pl. légzőizmok) izomcsoportokat is érint, ezért a betegek korai halálához vezet. A betegség kezelésére fejlesztettek ki egy rekombináns adeno-asszociált virális (rAAV) vektorokat tartalmazó génterápiás készítményt. A vektorok az SMN fehérje helyes kópiáját kódoló gént hordozzák, így a mozgatóneuronokba jutva helyreállítják azok működését, megőrizve az ideg-izom kapcsolatok funkcionalitását. Az egyébként rendkívül költséges (a kezelés ára kb. 700 millió forint) beavatkozás 2021 óta már elérhető állami finanszírozás mellett is, de a betegség először 2019-ben került reflektorfénybe, amikor is egy Zente nevű kisfiú számára, addig talán sosem tapasztalt társadalmi összefogással gyűjtötték össze a beavatkozáshoz szükséges csillagászati összeget. A sikeres kezelést követően Zente ma már közel teljes életet élhet.
Új terápiás utak
Intézetünkben hasonló sikertörténethez kívánunk hozzájárulni a transzlációs medicina kihívásokban gazdag, ámde annál nemesebb útjára lépve. Ahogyan korábban már volt szó róla, a génterápiás kezelések biztonságos és specifikus alkalmazásához elengedhetetlen a sejtek minél pontosabb megcélzása. A BrainVisionCenterben elsősorban a központi idegrendszert érintő orvosbiológiai kérdésekkel foglalkozunk. A legújabb kutatási eredmények szerint az emberi agyban körülbelül háromezer különböző sejttípus alkot bonyolult, finoman szabályozott hálózatot. Ha ez a harmonikus működés felborul, például a sejtek aktivitásának megváltozása következtében, akkor epilepsziához hasonló betegségek is kialakulhatnak.
Az epilepszia hazánkban csaknem a népesség 0,5%-át érinti, amely mintegy 50-60 000 főt jelent, és évente körülbelül 5000 új beteget diagnosztizálnak. Viszonyításként: olyan, mintha egy Eger méretű város minden egyes lakosa kénytelen lenne együtt élni egy életminőséget jelentősen romboló betegséggel. A megfelelő gyógymód iránti igény tehát megkérdőjelezhetetlen.
Jelenleg elektroenkefalográfiás (EEG) eljárással azonosítják az epilepsziás rohamokat kiváltó gócokat, amely agyterületeket – súlyos esetben – sebészeti eljárással távolítják el. Az EEG-módszer hátránya, hogy viszonylag nagy kiterjedésű agyterületről gyűjt információt, vagyis a hibás működésű sejtek egyedi beazonosítása nem lehetséges. Ennélfogva – az epileptikus gócok mellett – nagyméretű egészséges szövet is eltávolításra kerülhet, amely komoly, maradandó mellékhatásokat okozhat. Ezeknek az egyedi sejteknek a megcélzása azonban nem egyszerű feladat. Ahogyan az epilepszia esetében is láthatjuk, a probléma igazi megközelítését csak egy nagyítóhoz hasonlatos eszköz segítségével tehetjük meg, vagyis vizsgálnunk szükséges, hogy egy szabad szemmel látható fenotípusos jelenség (EEG-vel detektálható elektrofiziológiai elváltozás) mögött milyen molekuláris mechanizmusok húzódnak meg. Ha elektrofiziológiai, immunhisztológiai és különböző mikroszkópiás módszerekkel megállapítjuk, hogy mely sejttípusok okozhatják az elváltozást, lehetőségünk nyílik a sejtek egyedi célzására.
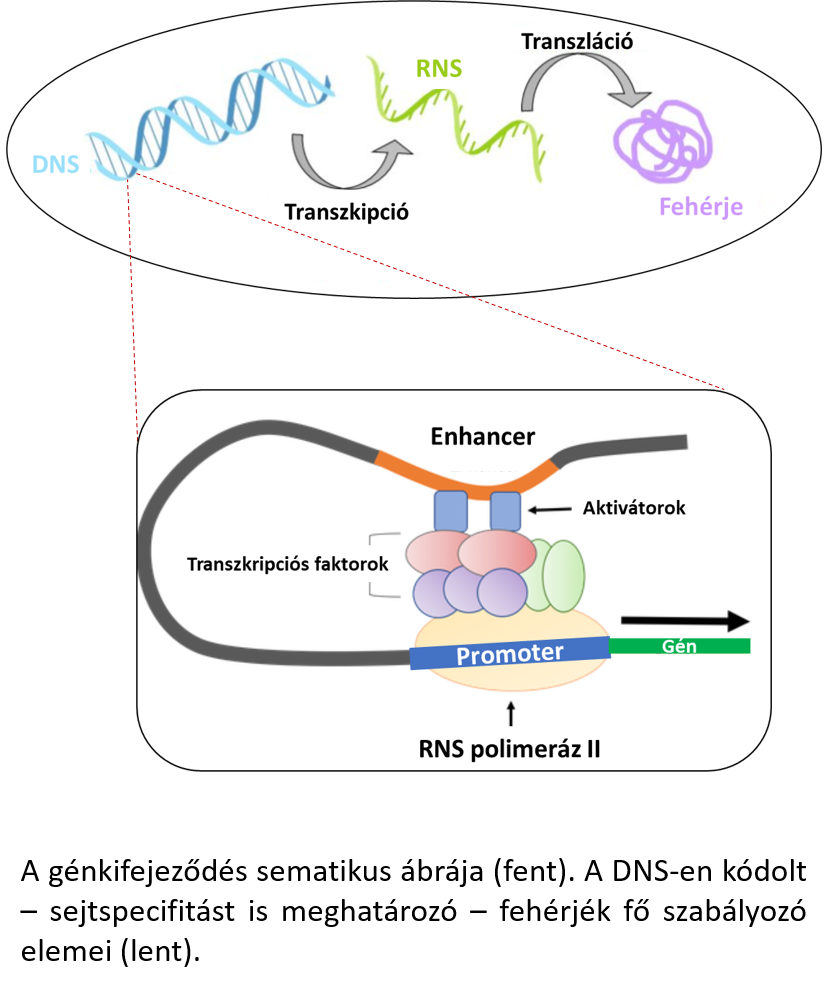
Ha alaposabban belenézünk egy sejt magjába, akkor az adott sejtre jellemző egyedi fehérjekifejeződés mintázata alapján fel tudjuk tárni a fehérjét kódoló gén kifejeződését meghatározó szabályozó elemeket. Ehhez elég segítségül hívni a középiskolai tanulmányaink során elsajátított ismereteinket, miszerint a centrális dogma alapján a fehérjék – RNS átíródáson keresztül – a DNS-ünkön kódolódnak. Ennek azért van jelentősége, mert minden fehérjét egy gén kódol, amelyet a saját promótere hajt meg. Szerencsés esetben ezeknek a promótereknek az aktivitása egyedi egy adott sejttípusra nézve. A promóterek működését legtöbb esetben úgynevezett enhanszerek segítik, amelyek felerősítik a génkifejeződést. A legújabb kutatási eredmények szerint a promóterek mellett az enhanszerek önmagukban is képesek determinálni egy-egy sejttípust, vagyis a kapszidfehérjéken túl ezek a genetikai elemek is képesek mintegy postai címként szolgálni a terápiás vektorok számára.
Intézetünk kiemelt küldetései között szerepel egy többpartneri együttműködésen alapuló projekt is. Laboratóriumi körülmények között túléltetett, humán agykéregből származó szöveteken keressük nagy áteresztőképességű rendszer segítségével azokat a sejtspecifikus promóter/enhanszer elemeket, amelyek terápiás szempontból meghatározó szereppel bírhatnak. Ezen genetikai elemek mögé fluoreszcens fehérjét kódoló géneket illesztünk molekuláris klónozási eljárással, majd rAAV vektorba csomagoljuk, és a szöveti fertőzést követően kétfoton mikroszkópiás technikával, valamint immunhisztokémiai módszerekkel vizsgáljuk a sejtspecifitást a fluoreszcens fehérjék kifejeződése alapján. (A vizsgálat alapját képező promóter/enhanszer könyvtár részben Roska Botond laboratóriumából származik, részben pedig saját fej-lesztésű vektorokat tartalmaz. A laboratóriumi körülmények között túlélő agyszövetek pedig a Szabó Arnold vezetésével megvalósuló kutatások eredményei.) Az ilyen módon azonosított specifikus genetikai elemek felhasználásával a későbbiekben lehetőség nyílik a kiválasztott sejtpopulációban terápiás szempontból releváns gének kifejeztetésére.
Összefoglalásul tehát elmondható, hogy a virális alapú génterápia napjainkban egyre nagyobb teret nyer. Egyes genetikai eredetű betegségek gyógyítására sok esetben nem is érhető el egyéb megoldás. A funkciójukat vesztett fehérjék pótlásására a leggyakrabban DNS vagy RNS örökítőanyagot juttatunk a sejtekbe rekombináns virális vektorok segítségével, amelyben mind a vírus burkolatát képező kapszid, mind a fehérje kifejeződését szabályozó promóter/enhanszer elemeket a célsejt minél hatékonyabb megtalálásának szolgálatába állítjuk. Láthattunk egy-egy példát az ex vivo és az in vivo génterápiára, amelyek sok esetben életmentő beavatkozást jelentenek a betegek számára. Célunk hatékony gyógymódot találni olyan, központi idegrendszert érintő betegségekre, mint például az epilepszia. Mindehhez szükséges a megfelelő sejtek azonosítása, amelyekhez humán agyszöveti mintákat vizsgálunk laboratóriumi körülmények között, terápiás szempontból releváns virális vektorok segítségével.
A vírusok – egyébként sem fényes – megítélésén a Covid19-világjárvány tovább rontott. Ugyanakkor, ha hatékony gyógymódot akarunk találni olyan, központi idegrendszert érintő betegségekre, mint például az epilepszia, szükség van rájuk. A megfelelő sejtek azonosítása után – amelyekhez humán agyszöveti mintákat vizsgálunk laboratóriumi körülmények között, terápiás szempontból releváns virális vektorok segítségével – megfelelő kezekben a gyógyítás eszközéül is szolgálhatnak, és akár emberi életeket is megmenthetünk a segítségükkel.
Szepesi Áron
vezető biológus
BrainVisionCenter Kutatóintézet és Kompetenciaközpont





