A mindössze 34 éves Horváth Péter eddigi pályája a példa arra, hogy egymásba csúszó tudományterületek miként járulnak hozzá a világ jobb megismeréséhez. A szegedi egyetemen programozó matematikusként végzett, majd egy Nizza melletti kutatóközpontban dolgozva műholdképek feldolgozásának témájából doktorált kutató a zürichi műszaki egyetemen kötött ki. Ott a mikroszkópok által alkotott képek elemzésével foglalkozva jött rá, hogy ez a két módszer igencsak hasonló. Családjával Szegedre költözött, s azóta az MTA Szegedi Biológiai Kutatóközpont (SZBK) Biomag- (biológiai képelemző és mesterséges intelligencia-) csoportjának vezetőjeként folytatja munkáját.

– Alig tért haza, nevét máris szárnyra kapta a magyar sajtó egy nagy port felvert Science-cikk kapcsán, melyet svájci kollégákkal közösen közöltek, s amelyet nagy áttörésnek tartanak az influenza elleni harcban. Mérnök, matematikus létére nem idegen ez a terület önnek?
– A mikroszkópok világa áll igazán közel hozzám. A svájci kutatócsoportban hat éve kezdtünk foglalkozni egy akkor feltörekvő kutatási témával, a nagyfelbontású mikroszkóppal végezhető automatizált gyógyszer- és génszűréssel. Nem érthet mindenki mindenhez, de a maga területén kiváló biológusnak, kémikusnak, fizikusnak, matematikusnak valamelyest ismernie kell a cél érdekében más szakterületeket is. Ezzel az összetett, összehangolt munkát igénylő témával foglalkozó kutatók ezért is külön társaságba tömörültek: az európainak én lettem az elnöke, a világméretűben testületi tag vagyok. A szegedi csoport vezetőjeként is arra törekszem, hogy a különböző tudományokban jeleskedő kutatók megtanuljanak egymással kommunikálni, ne féljenek átadni tudásukat kollégáiknak.
– Ezek szerint önben a pedagógus, a pszichológus sem veszett el. De térjünk vissza az influenzavírus elleni támadásra. Miféle kísérletek vezettek a szenzációs eredményhez?
– Egyenként kikapcsoltuk az összes emberi gént, hogy megvizsgáljuk különböző baktériumok, vírusok – az influenza mellett herpesz, AIDS és szalmonella – fertőző mechanizmusát. Azt, hogyan viselkednek, ha egy-egy gént kikapcsolunk. Ehhez kellett ez a fejlett technika, hiszen sok ezer gén vizsgálata e nélkül képtelenség lenne. Kísérletenként több tízmillió kép készült több százmilliárd sejtről. Olyan módszereket fejlesztünk, amelyek automatikusan feldolgozzák az adatokat, s ezekből mesterséges intelligenciával következtetéseket tudunk levonni.
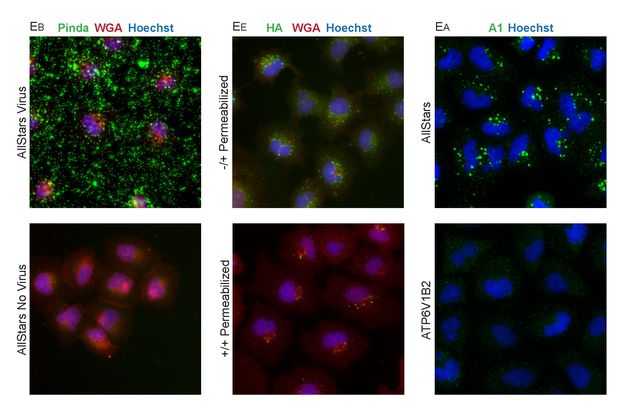
Alsó sorok: nem fertőzött sejtek egy az influenzafertőzés számára szükséges gén kikapcsolása után.
– Miért éppen az influenzavírusra fókuszáltak leginkább?
– Igaz, hogy nem ez a legsúlyosabb betegség, de járványok idején ezrével képes ledönteni az embereket a lábukról, akik a szenvedés mellett kiesnek a munkából, és ez országos és világméretben is anyagi veszteséggel jár. Ugyanakkor köztudott: az influenza ellen nincs gyógyszer, védekezni ellene csak legyengített vírusokból készített védőoltással tudunk. A Svájcban öt éve elkezdett kutatás során azt vizsgáltuk, mely emberi gének játszanak szerepet a fertőzésben. De ennél is tovább mentünk: kíváncsiak voltunk arra, a fertőzés mely fázisában hatnak a vírusra. Pontos térképet kaptunk arról, hol játszik szerepet az adott gén – vagy majdan gyógyszer – a fertőzésben, gátolja vagy serkenti a betegség terjedését. Nagyon összetett, kifinomult módszereket kellett fejlesztenünk, míg rengeteg, szerteágazó ismeret ötvözésével találtunk egyetlen gént, amelynek viselkedését mélyebben elemezve kiderítettük: az influenzavírus egy úgynevezett „szemétkapszulának” álcázza magát. Amikor a vírus bejut a sejtbe, a kapszulából ki kell csomagolnia az örökítőanyagot ahhoz, hogy ez a sejtmagba bejuthasson, s a sejt elkezdje lemásolni, sokszorozni.
– Melyik az a korszakalkotó felismerés, amely utat nyit egy majdani influenza elleni gyógyszer fejlesztéséhez?
– Felfedeztük, hogy miként bírja rá a vírus a gazdasejtet erre a kicsomagolási mechanizmusra. A vírus olyan sejtalkotónak álcázza magát, amelyben már hibás fehérjék gyűltek össze, amelyeket a sejt kilök magából. Ezt csak úgy tudja megtenni, ha kisebb darabokra szedi őket. Ehhez azonban ki kell nyitnia a kapszulákat. A magát szemétkapszulának álcázó vírussal tehát megfertőzi magát a sejt, örökítőanyaga a sejtmagba jutva, szaporodni kezd. Amikor ezt a gént kikapcsoltuk, a vírus nem tudta megfertőzni a sejtet.
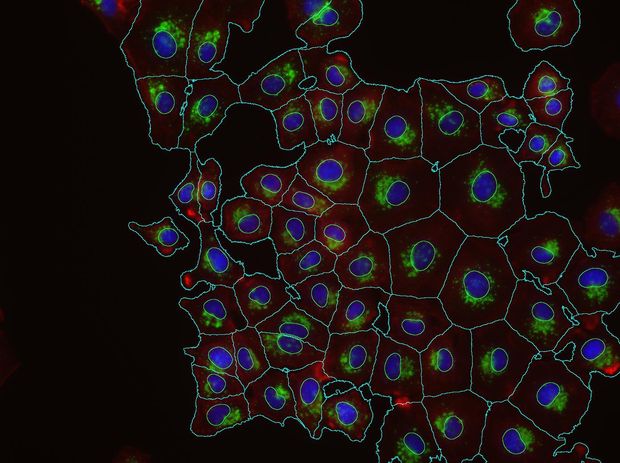
– Laboratóriumban tehát ezt bizonyították. Honnan lehet tudni, hogy ez a felismerés az emberi gyógyászatban is hasznosítható lehet?
– Állatkísérletekben is tudtuk ezt bizonyítani. Ahhoz, hogy erre az alapkutatási eredményre építve orvosságot kínáljanak a gyógyszergyárak a betegeknek, öt-tíz évet várniuk kell.
– S hogyan tovább? Míg mások Nyugatra tartanak, ön előtt két út állt, s a hazavezetőt választotta. Mivel foglalkozik újonnan létrehozott csoportja az SZBK-ban?
– Valóban: maradhattam volna külföldön, de családommal vágytunk vissza Magyarországra, s kifejezetten Szegedre. Hívtak a Harvardra is, nem tagadom, hosszasan gondolkodtam a lehetőségen. Közben megpályáztam egy finn ösztöndíjat, melyen nyertem, így Helsinkiben, egy molekuláris medicinával foglalkozó intézetben is létrehozhattam egy csoportot, amely a rákgyógyításban alkalmazható, személyre szabott medicina tökéletesítését tűzte ki célul. Mivel szerettem volna hazahozni a svájci technológiát, és erre lehetőséget kínált az SZBK, a hazatérést választottam. Sikerrel pályáztam meg a Nemzeti Agykutatási Programot, támogatást kapunk egyebek mellett a Nemzeti Kiválóság Programtól is. Szegedi munkatársaimmal az emberi agyból származó szövetmintákban szeretnénk megtalálni egyes sejteket, amelyeket valamilyen szempontból a biológia különlegesnek gondol. Ebből a célból szorosan együttműködünk az ugyancsak szegedi Tamás Gábor és Vígh László akadémikusok orvos- és biológus-kutatócsoportjaival.
CHIKÁN ÁGNES
2015/3





