Genetikai örökítőanyagunkat minden sejtünk tartalmazza, életünk első pillanataiban ugyanazzal az információtartalommal rendelkezünk, mint életünk legvégén. Gyermekünknek anyánk és apánk génjeinek egyedi keverékét adjuk át, amit mi is szüleinktől és az ő szüleiktől örököltünk. Ennyire stabil lenne az az óriásmolekula, amelyet a tudományos nevezéktan dezoxiribonukleinsav névvel illet? E kérdés legelső feltevője és egyik megválaszolója, Tomas Lindahl, a többi válaszadóval együtt idén kémiai Nobel-díjat kapott.
Nem, a DNS nem ennyire stabil. De kezdjük az elején. Miből áll a DNS-ünk? Egy öt szénatomos cukormolekula egyik oxigénjéhez csatlakozik egy foszforcsoport, egy másik oxigénjéhez egy másik foszforcsoport, amely egy újabb cukormolekulával van összeköttetésben. Így épül fel a lánc. A láncszemeket képező cukormolekula egy újabb oxigénjéhez tud csatlakozni egy bázisnak nevezett molekula, amely négyféle lehet: adenin (A), citozin (C), guanin (G) vagy timin (T). Ezeknek a bázisoknak a sorrendje képezi a genetikai kódot. A foszfát-cukor lánc gerinc képezi a dupla-hélix alakú molekula külső gerincét, a bázisok a központ felé, egymással A-T, G-C szabály szerint állnak párba.

Ezek a bázisok tárolják a genetikai információt, amelyről a sejtben fehérje keletkezik. Ha a DNS a műszaki könyvtár, akkor a fehérje megtervezett és megépített gép, a fehérjekomplexek a gyárak és a sejt maga a város, amely épít, átalakít, megszüntet, tovább ad, és minderről információt tárol. Egyes fehérjéket enzimeknek nevezünk, a továbbiakban elsősorban ezekről a fehérjékről lesz szó.
Ezek a bázisok kémiailag igen hasonló szerkezetűek. Vizes közegben előfordul apró változás bennük, ami azt eredményezheti, hogy a párosodási szabálynak nem megfelelően szeretnének csatlakozni egymással. Például, ha a citozin egyik amino-csoportja leesik, ekkor a szabályos citozin-guanin kapcsolat helyett az adenint fogja preferálni. Ha ez a változás bekövetkezik, az osztódó sejt osztódó DNS-ének egyik szála, amelyik a módosult citozin alapján keletkezik, rossz kódot fog tartalmazni. Ennek a mutációnak a javítására a sejt rendelkezik egy speciális enzimmel, amelynek felfedezéséért Nobel-díjjal jutalmazták Tomas Lindahlt.
A bázisok nem csak spontán változhatnak meg. Az UV-sugárzás energiája nagyobb, mint a DNS óriásmolekulában lévő kötések energiája, ezért ha egy ultraviola hullámhosszal rendelkező foton éppen eltalál a DNS-en belül egy kötést, a kötés felhasad. A kötés felhasadásakor a molekulának ezen része magasabb energiaszintre lép, ahonnan idővel visszakerül a nyugalmi állapotba. A nyugalmi állapot azonban nem feltétlen jelenti, hogy újra összekapcsolódik a korábbi párjával. A timin gyakran azonos láncon lévő timinnel kapcsolódik, ahelyett, hogy a szemközti adenin párjához kapcsolódna. Ezzel megváltozik a térszerkezet, amelyet egy fény hatására és egy sötétben is aktiválódni képes enzim javít ki. Ezeknek az enzimeknek a felfedezésében és vizsgálatában játszott kiemelkedő szerepet az idén szintén Nobel-díjjal jutalmazott Aziz Sancar.
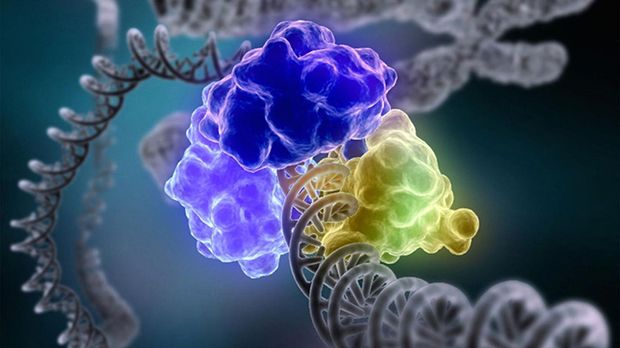
A harmadik Nobel-díjas munkájának megértéséhez át kell néznünk, hogy miként újul meg a DNS. A DNS két szállal rendelkezik. Amikor a sejt osztódáshoz készülődik, először a DNS-ét kettőzi meg. A DNS megkettőződésének első lépése a két DNS-szál egymástól való elválása. Mind a két szál mintául fog szolgálni egy-egy új kettős hélix kialakulásához, mert mindkét régi szál mellé egy-egy új szál képződik. A minta pontos másolását is egy enzim végzi. Ez az enzim minden egyes lépésben kiválasztja a mintaszálon lévő bázisnak megfelelő új bázist. Nagyjából minden egymilliomodik bázisra jut egy hibás beépülés, ami nagyon jó arány, de még okozhatna gondot. Ennek elkerülése végett minden új elem beépülésekor ellenőrzi a másoló enzim, hogy jót választott-e, így csökkenti századrészére a hiba lehetőségét, vagyis egy hiba esik minden százmillió beépülésre. A másoló enzim saját javítófunkcióján kívül még más enzimek is közrejátszanak ebben a működésben. A folyamatban szerepet játszó enzimek felfedezése és vizsgálata Paul Modrich nevéhez fűződik, aki az idei kémiai Nobel-díj harmadik nyertese.
Mindezen felfedezéseknek hatalmas jelentősége van. Legkézenfekvőbb a rákos sejtek megnövekedett mutációs rátájára gondolni, ami feltételezi ezeknek a mechanizmusoknak a deficienciáját. Az idei Kémiai Nobel-díjasok felfedezéseit alapul véve a gyógyszeripar már ki is fejlesztette az olaparibnak elnevezett hatóanyagot, amely tovább gátolja a rákos sejtekben a javítómechanizmusok működését, ezzel sejtpusztuláshoz vezető károkat okozva a rákos szövetben.
FERENC KATA
2015/44





