A terhesség immunológiai rejtély. A petesejt és a hímivarsejt találkozásakor a kialakuló zigóta genetikai állományának felét az anyától, a másik felét pedig az apától örökli, így a fejlődő magzat fele részben apai, az anyai immunrendszer számára idegen antigéneket hordoz. Az allograftok olyan transzplantátumok, amelyeknek átültetése genetikailag nem azonos, de egyazon fajhoz tartozó egyének között történik. Ezek kilökődéséért immunrendszerünk tehető felelőssé, tehát az anyában a terhesség ideje alatt zavartalanul fejlődő, részben allograftnak minősülő magzat immunológiai paradoxonnak tekinthető.
A magzat túlélése szempontjából logikus lenne, hogy az apai eredetű antigének az anyai immunrendszer számára rejtve maradjanak, és így felismerésük gátolt legyen. Jelenlegi ismereteink szerint azonban a magzat jelenlétének immunológiai felismerése kifejezetten szükséges ahhoz, hogy elindítsa azokat a mechanizmusokat, melyek a továbbiakban a védelmét szolgálják az anya immunrendszerével szemben.
Az anyai immuntolerancia kialakításában számos folyamat vesz részt, melyek együttes jelenléte és összehangolt működése együtt biztosítja a magzat zavartalan fejlődését. Egyik ilyen tényező a magzat anatómiai elhelyezkedése az anya szervezetén belül, valamint az anyától elválasztó, illetve összekötő szövetek speciális tulajdonságai. A magzati eredetű trofoblaszt sejtek képezik az anyai és a magzati felszínek közötti érintkezési felületet, melyről hiányoznak a magzat immunológiai ujjlenyomatának tekinthető klasszikus hisztokompatibilitási antigének (HLA). Kimutathatóak rajta viszont trofoblaszt szövetspecifikus antigének (HLA-G, HLA-E), melyek jelenléte védheti a trofoblasztot az anyai eredetű deciduális szövet citotoxikus T-sejtjei, illetve NK-sejtjei által közvetített lízissel szemben.
A magzat és az anya immunológiai kapcsolata tehát olyan kétoldalú folyamat, melyet magzati részről a magzatra jellemző antigének prezentálása, anyai részről pedig azok felismerése és reagálva rá az immunválasz mértéke határoz meg. A terhesség alatt az anyai immunválaszokat szabályozó immunregulációs folyamatok megfelelő működése rendkívül fontos az előbb említett két ellentétes folyamat közötti egyensúly kialakításában. Ennek az egyensúlynak a megléte biztosítja a magzat fejlődését, illetve megbomlása koraszüléssel, terhességi toxémia (pre-eclampsia) kialakulásával is járhat. A terhesség sikeres kiviseléséhez tehát szükséges az anyai immunválasz alkalmazkodása a magzat jelenlétéhez, de az anyai toleranciamechanizmusokban bekövetkező változás akár infertilitáshoz vagy terhességi pathológiás állapotokhoz is vezethet. A terhességi toxémia vagy az immunológiai eredetű vetélés sajnos igen gyakoriak és mind az anyára, mind pedig a magzatra nézve súlyos következményekkel járhatnak. Az elmúlt évek intenzív kutatásai ellenére sem mutatkozik jelentős előrelépés e betegségek korai felismerésének és megelőzésének területén.
Egy molekulapár kulcsszerepben
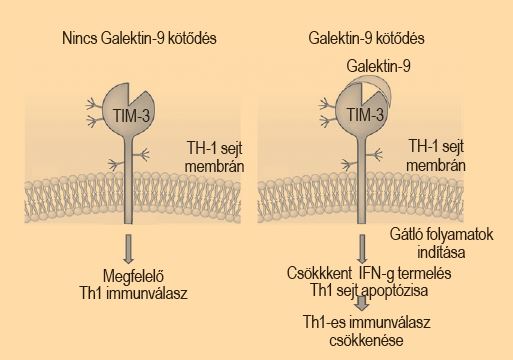
Kutatócsoportunk ezt az immunológiai kapcsolatot új oldaláról próbálja tanulmányozni; egy, a közelmúltban azonosított molekulapár jelenlétét és hatásmechanizmusát vizsgálja a terhesség ideje alatt. Ez a két molekula a TIM-3 (T sejt Immunglobulin és Mucin domain 3), illetve a Galektin-9, melyeknek immunológiai toleranciában betöltött szerepére számos nemzetközi folyóiratban megjelent tanulmány hívja fel a figyelmet. A TIM-3 egy receptor típusú molekula, melynek azonosítását a Nature folyóiratban publikálták 2002-ben. Elsősorban az érett, elkötelezett T helper 1-es (Th1) limfociták felszínén található meg, de érdekes módon a T helper 2-es (Th2)-es limfocitákon nem fejezik ki.

A receptor kapcsolódó molekuláját, vagyis ligandját, a Galektin-9-et, valamivel később találták meg, melyre elsősorban a szöveti megjelenés jellemző, jelenlétét kimutatták tímusz, vagyis csecsemőmirigy, továbbá lép-, tüdő- és veseszöveteken is. Kapcsolódásuk révén hozzák létre a TIM-3/Galektin-9 útvonalat, amely során a receptorral rendelkező sejt apoptózis formájában sejthalált szenved, ezáltal a csökkenti a Th1-es immunválaszok túlsúlyát, ami pedig szerepet játszhat a perifériás tolerancia létrejöttében.
A receptor és ligandja megjelenését, illetve kapcsolódásuk funkcionális következményeinek hatását elsősorban autoimmun és transzplantációs kísérletekben vizsgálták. Hatásmechanizmusáról terhesség, illetve patológiás terhesség viszonylatában azonban igen keveset tudunk, többek között ezért is fordítottuk figyelmünket a téma irányába.
Három szakasz
Jelen kutatásunk célja az anyai immuntolerancia kialakításában részt vevő komplex immunszabályzó mechanizmusok felderítése, funkcionális jellemzése, továbbá a TIM-3 és a Galektin-9 molekulák, valamint hatásmechanizmusuk lehetséges szerepének bizonyítása a normál terhesség lefolyásában és patológiás viszonylatban. Több kísérleti vonalon indultunk el, melyek állatkísérletes vizsgálatokat és humán minták feldolgozását is magukban foglalták.
A humán kísérletek a Pécsi Szülészeti Klinikával együttműködve indultak el, mely kezdetben a terhesség három trimeszteréből származó perifériás vérmintákból izolált limfociták fenotípusos vizsgálatát jelentette. Arra voltunk kíváncsiak, hogy az egészséges terhesség három szakaszában van-e különbség a két molekula kifejeződését illetően különböző immunsejt populációkban. Ezt a kísérletünket későbbiekben kiegészítettük terhességi toxémiás nők perifériás véréből izolált limfociták analízisével, így átfogó képet kaptunk arról, miként változik a TIM-3 és a Galektin-9 kifejeződése egészséges terhességben és egy pathológiás állapotban.
Egészséges terhesség egérmodelljének segítségével arra keressük a választ, hogy az anya-magzat határon korábban általunk kimutatott Galektin-9 molekula miként befolyásolja a TIM-3 molekulához köthető lokális immunológiai folyamatokat. Kísérletünkben terhes egerekből szeparált deciduális és perifériás limfociták funkcionális változásait (citokin termelés, citotoxicitás) vizsgáljuk Galektin-9 molekulával történő stimulációt követően. Fontos kérdés, hogy a Galektin-9 kezelés miként befolyásolja a Th-1-es immunválasz leszabályozását, illetve további in vivo alkalmazása képes-e megakadályozni a magzat kilökődését.
Érdekes kísérletnek ígérkezik humán terhességmegszakításból származó minták feldolgozása is, mely során lehetőségünk nyílik különböző trofoblaszt sejtek és deciduális limfociták izolálására, valamint az általunk vizsgált két molekula expressziós szintjének meghatározására. Így az egérkísérlethez hasonlóan lényeges információkhoz juthatunk az anya-magzat határfelületen bekövetkezett változásokról, ezúttal humán vonatkozásban.
Eddigi eredmények
Kiindulva az irodalmi adatokból, miszerint a TIM-3 receptor kapcsolódása a Galektin-9 liganddal a donorsejt apoptózisát jelenti, feltételezzük, hogy a terhesség előrehaladtával megemelkedik a Th1-es limfociták receptor kifejeződése, ami elősegítheti ezen sejtek apoptózisát és szerepet játszhat az immunválasz Th2-es irányba való eltolásában, ami a terhesség alatt bizonyított.
Eddigi kísérleteink során kimutattuk, hogy az NK-sejtek lényegesen nagyobb mennyiségben fejezik ki felszínükön a TIM-3-molekulát szemben a többi sejtpopulációval, illetve a kifejeződés mértéke a terhesség három trimesztere alatt nem azonos. További eredményünk, mely szerint azok a citotoxikus T-, illetve NK-sejtek, melyeken nem található meg a TIM-3 receptor, potenciálisan citotoxikusabbak, jelezheti a TIM-3-on keresztüli tolerancia létrejöttét. Ezzel szorosan összefügghet a vérből mért keringő Galektin-9 molekula emelkedő mennyisége a terhesség előrehalad-tával.
Kutatásunkat tovább folytatva a terhességi toxémiás minták vizsgálatakor egy csökkent TIM-3 receptor kifejeződést mértünk szintén a citotoxikus T-, és NK-sejtek felszínén, ami magyarázatul szolgálhat az emelkedett Th1-es immunválaszok létrejöttében, ami a terhességi toxémia egyik jellemzője.

Egérkísérleteinknél a tervezett Galektin-9 molekulával való kezelés során egy emelkedett mértékű apoptózisra számítunk a Th1-es és citotoxikus limfociták populációiban. Ezekből a perifériás eredményekből következtetni tudunk, hogy lokálisan a trofoblaszton lévő Galektin-9-hez milyen funkció társulhat. Véleményünk szerint ez a trofoblaszt-sejteken lévő Galektin-9 lesz a fő hajtóereje az anya-magzat határfelületen lévő citotoxikus sejtek eliminálásának. Ebből kiindulva pedig a trofoblaszton lévő Galektin-9, illetve a Galektin-9 mennyisége egy potenciális jelző marker lehetne bizonyos patológiás terhességek esetében.
A koraszülés és a toxémia megelőzhető
Az immunológiai tolerancia mesterséges létrehozása és fenntartása az orvostudomány máig egy kívánatos és nehezen megvalósítható célja. Szervtranszplantációval foglalkozó kísérletek, illetve a klinikai transzplantációs beavatkozások lényeges eleme, hogy a befogadó szervezet immunológiailag tolerálja a donorból származó szervet/szövetet. Az immuntolerancia kialakításáért felelős folyamatok megismerése lényeges eleme lehet a különböző autoimmun-megbetegedések innovatív kezelésében, továbbá sejt- és szervtranszplantációs kísérletekben fejlesztésében is.
Az anyai immuntolerancia az evolúció során kialakult természetes folyamat, komplex mechanizmusainak megismerésével képesek lehetünk olyan új terápiás stratégiák kidolgozására, melyekkel immunológiai toleranciát válthatunk ki. Felhasználhatjuk továbbá az immunológiai háttérrel rendelkező terhességi komplikációk megelőzésében, mint pl. a terhességi toxémia vagy a visszatérő vetélés és koraszülés. A TIM-3 és Galektin-9 molekulák kifejeződésének, interakciójának és funkciójának részletesebb megismerésével lehetőségünk nyílhat, hogy terápiás céllal beavatkozzunk e szabályozó útvonalak működésébe. Az anyai immuntolerancia fiziológiás viszonyainak pontosabb megismerésével kapott új információk birtokában pedig hasznos támpontokat szerezhetünk az érintett betegségek korai diagnózisa, illetve későbbi sikeres terápiájának kiválasztása céljából.
MEGGYES MÁTYÁS
OTKA
104960
PUB-I 113547
2015/22