A kemoterápiás kezelések jelenleg sajnos a gyorsan osztódó, de egészséges sejteket is komolyan károsítják, ezért lépnek fel olyan mellékhatások, mint a hajhullás, hányás, hányinger és az immunrendszer állapotának általános leromlása. A jövőben ezt úgy lehetne kiküszöbölni, hogy a tumorellenes hatású szerves kismolekulákat kizárólag a daganatsejtek belsejébe juttatjuk be – mondja Mező Gábor, az MTA-ELTE Peptidkémiai Kutatócsoport tudományos tanácsadója, az MTA doktora.

– Mikor fordult az érdeklődése a kémia, ezen belül pedig a peptidkémia felé?
– Édesapám szintén peptidkémikus volt, és már kiskoromban többször bevitt a laborjába – így ez a környezet már egészen fiatalon is ismerős volt számomra. Később az általános iskolában is a kémia kezdett a leginkább érdekelni, a rendkívül jó kémiatanárnőmnek, Köpeczi Imolának köszönhetően. Az egyetemen szintén erre a tudományágra szakosodtam, végül 1990-ben lettem a kémiai tudomány kandidátusa, 2000-ben pedig az MTA doktora. Fő kutatási területem a hatóanyagok szelektív célba juttatására alkalmas biokonjugátumok szintézise és vizsgálata lett, és jelenleg is ezen a témán dolgozom a legaktívabban. A Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal által kiírt Nemzeti Versenyképességi és Kiválósági Program egyik alprogramjának köszönhetően több mint egymilliárd forintnyi támogatást sikerült elnyernünk a kutatási projektünkkel. A célunk egy három modulból álló vegyülettár kialakítása, amelyben az egyes modulok komponensei nagy variációs lehetőséggel kombinálhatók, és így olyan tumorellenes konjugátumok állíthatóak elő, amelyek a különféle daganattípusok széles skálájában alkalmazható, személyre szabott daganatterápiás eljárások kifejlesztését teszik majd lehetővé a jövőben.
– Milyen modulokból épül majd fel ez a vegyülettár?
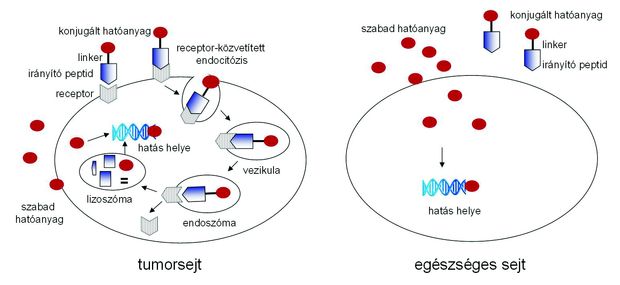
– Tumorellenes hatású szerves kismolekulákból, a tumorsejteket célzó irányító peptidekből, valamint az első két komponenst összekapcsoló bifunkciós linkerekből. A mi elképzelésünk a kemoterápia egy célzott formáján alapul, amelynek során – a tumorsejteket célzó irányító peptidek segítségével – kizárólag a daganatsejtek belsejébe próbáljuk meg bejuttatni a tumorellenes hatású szerves kismolekulákat. A tumorellenes hatóanyagok célzott bejuttatásának koncepciója egyáltalán nem új, azonban az eddigi kutatásokban főleg ellenanyagokhoz kötötték hozzá a tumorellenes hatóanyagokat, de ez az eljárás sajnos – az esetek döntő többségében – eddig nem bizonyult kellően hatékonynak. Az ellenanyagok felismerték ugyan a sejtfelszíni struktúrákat, tumor-antigéneket, a hatóanyag megfelelő mennyiségben történő sejtbe juttatását azonban már csak viszonylag ritkán sikerült elérni. Mi éppen ezt a problémát szeretnénk megoldani azáltal, hogy nem ellenanyagokhoz, hanem kis méretű irányító peptidekhez kapcsoljuk hozzá a vegyülettár tumorellenes kismolekuláit. Egy-két ilyen típusú vegyület is eljutott már klinikai kipróbálás fázisába, de ezeket a vegyületeket egyedi tumorokra fejlesztették ki. Egyelőre az alapkutatási fázisban – labor- és állatkísérletek – vagyunk, így a klinikai vizsgálatok még messze vannak. Ha azonban a módszerünk végül hatékonynak bizonyul, akkor végre valósággá válhat a daganatsejtekhez hasonlóan szintén gyorsan osztódó, de egészséges sejtek megkímélése.
– Milyen hatóanyagokat tartalmaz pontosan a kialakítandó vegyülettár?
– Részben a már jelenleg is klinikai használatban lévő tumorellenes molekulák kémiai módosításával – funkciós csoportok beépítésével – hozunk létre új vegyületeket, részben saját fejlesztésű molekulákat fogunk használni. Erre azért van szükség, hogy a különféle hatóanyag-molekulák hozzákapcsolhatóvá váljanak az irányító peptidekhez. Ez utóbbiak részben a már ismert tumorsejtfelszíni receptorokhoz képesek kapcsolódni, részben pedig az ilyen szempontból eddig még nem vizsgált receptorokhoz próbálunk hatékonyan kötődő peptideket tervezni. A kiválasztott peptidek szerkezetét sokszor szintén módosítani kell annak érdekében, hogy a lehető legerősebb kötődést érjük el. A vegyülettár harmadik elemét a linkerek alkotják. Ezek a molekulák általában bifunkciós linkerek, ami azt jelenti, hogy kétféle funkciós csoportot is hordoznak: az egyik tud magához a tumorellenes hatóanyaghoz kötődni, a másik pedig az irányító peptidhez csatlakozik. A kétféle kötést szelektíven próbáljuk meg kialakítani, lehetőleg „egy-üst” (one-pot) reakcióban. A linkerek feladata az is, hogy amikor a konjugátum bejut a szelektíven megcélzott tumorsejtbe, a linker elhasadjon, és vagy a szabaddá vált hatóanyag, vagy ennek egy aktív metabolitja a daganatsejtben kifejtse hatását.
– Milyen daganattípusokon tesztelik jelenleg a vegyülettár elemeit?
– Az új hatóanyagok és irányító peptidek vizsgálata és az aktív vegyületek kiválasztása után, a vegyületek különféle kombinációiból előállított konjugátumok tumorsejteken történő tesztelése várhatóan 2018-ban fog megkezdődni, ezt követően pedig az Országos Onkológiai Intézet állatházában zajlanak majd az állatkísérletek. A mi kutatásunk nem a leggyakoribb, hanem a legnagyobb halálozási arányt mutató daganattípusokra koncentrál elsősorban. Ezeket a daganatokat jelenleg nem igazán lehet sem kemoterápiával, sem sebészeti eltávolítással vagy sugárkezeléssel meggyógyítani. Ilyen többek között a mindössze 5 százalékos egyéves túléléssel jellemezhető hasnyálmirigyrák, a tüdőrák késői stádiumú fajtái, valamint a már áttéteket is adott melanomák. Az a jövőben sem valószínű, hogy ezeket a tumorokat egyféle kezeléssel meg lehessen gyógyítani. A különféle, az esetek egy részében már jelenleg is eredményes kezelések kombinációi mellett azonban a mi megközelítésünk is egy hatékony terápiás megoldást jelenthet majd a daganatellenes kezelések meghatározott fázisaiban. Bár a konjugátumaink hatékonyságát elsősorban a három említett daganattípuson vizsgáljuk majd, néhány további tumortípuson – agydaganatok, vastagbélrák, emlőrák, prosztatarák – is meg szeretnénk határozni a módszerünk hatékonyságát. Ez utóbbiakat ma már szerencsére viszonylag jól lehet kezelni azokban az esetekben, amikor a daganatokat még a korábbi stádiumokban felismerik.
– Hogyan kapcsolódnak az Önök kutatásai az Európai Unióban zajló hasonló kutatásokhoz?
– Az Európai Unió Horizont 2020 kutatási és innovációs keretprogramja révén 3,75 millió euró támogatással valósul meg a „MAGICBULLET” projekt, amelynek az MTA-ELTE Pep-dtidkémiai Kutatócsoport is tagja. Ennek a támogatásnak köszönhetően a konzorciumban (német, olasz, finn, magyar egyetemek, egészségügyi intézmények és gyógyszergyárak) jelenleg összesen 15 PhD hallgatót tudunk foglalkoztatni, akik nemzetközi környezetben tudnak bekapcsolódni a kutatásokba. A „magic bullet” – magyarra fordítva leginkább talán „mágikus golyó” – a gyógyszerek irányított célba juttatására alkalmas konjugátumokat jelenti, amelyek létrehozása a mi konzorciumunknak is az elsődleges célja. Ezeknek a konjugátumoknak az ötlete egyébként meglehetősen régre nyúlik vissza: a Nobel-díjas Paul Ehrlich (1854-1915, fiziológiai Nobel-díj, 1908) már az 1900-as évek elején előre vetítette, hogy egyszer talán ezen a módon fog zajlani különböző betegségek célzott kezelése. Ezt egyelőre a daganatterápiában még nem értük el, de a biztató kísérletek alapján kijelenthetjük, hogy remélhetőleg már nem vagyunk nagyon messze tőle.
ILLYÉS ANDRÁS
2017/34





