A pikkelysömör az életminőséget nagymértékben rontó bőrbetegség, amelynek kezelése jelenleg a tünetek mérséklésére korlátozódik, egyrészt hagyományos kezelési módszerekkel, másrészt a napjainkban egyre nagyobb teret nyerő biológiai terápiás szerekkel. Noha az esetenként súlyos szisztémás tüneteket is okozó bőrbetegségek közül a pikkelysömör az egyik leggyakoribb, kialakulásának molekuláris hátterét mégis csak részben ismerjük. Az elmúlt években munkacsoportunk a kórképre jellemző hámsejtek és T-limfociták funkciózavarainak kibontakozását kutatta.
A pikkelysömör avagy pszoriázis krónikus, gyulladásos bőrbetegség, amely Európában a lakosság 1–2 százalékát érinti. A betegséget kísérő legjellegzetesebb elváltozások a környezetüktől élesen elhatárolódó elszarusodott foltok: a plakkok, amelyek felszínét ezüstös színű „pikkely” borítja. Utóbbiak könnyen leválaszthatók, alattuk a bőrön vörös és pontszerű vérzéseket figyelhetünk meg. Típusos esetben a könyököt, térdet és hajas fejbőrt érintik ezek a tünetek, de átterjedhetnek a körmökre is. Súlyosabb lefolyású pikkelysömörben a plakkok akár az egész testet befedhetik.
Ikerkísérletek bizonyítéka
Az elmúlt években számos vita folyt arról, hogy bőr- vagy inkább szisztémás betegségnek tekintendő-e a pikkelysömör. Több érv szól az utóbbi mellett is: különböző anyagcsere-eltérések csatlakozhatnak a betegséghez, amelyek miatt a kórképben szenvedőknek fokozott a kockázata a szív- és érrendszeri megbetegedésekre, így például szívinfarktusra és sztrókra. A pikkelysömör bizonyos altípusaiban ízületi panaszok is megjelenhetnek, amelyek változó súlyosságúak. Mindezek mellett nem elhanyagolható a betegség által előidézett pszicho-szociális stressz sem. Ugyanakkor a betegség legjelentősebb megnyilvánulásai a bőrhöz köthetők, emiatt egyértelműen a bőrgyó-gyászati kórképek között tárgyalják.
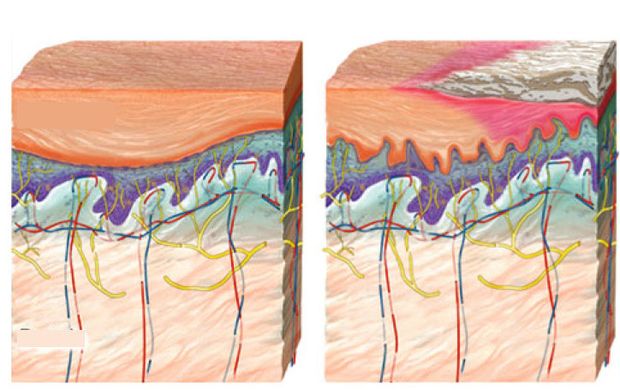
A betegség kiváltó okairól viszonylag keveset tudunk. A tünetek kifejlődésében valószínűleg mind az örökletes, mind pedig a környezeti tényezők fontos szerepet töltenek be. A legutóbbi években több olyan egyedi genetikai eltérést azonosítottak – ezeket polimorfizmusoknak nevezzük –, amelyek megléte hajlamosabbá tehet a betegségre. Meg kell jegyeznünk azonban, hogy ezek az eltérések önmagukban nem tekintendők kiváltó tényezőnek, hiszen a pikkelysömör komplex öröklésmenetet mutató, poligénes betegség. Továbbá nem szabad elfeledkeznünk a környezeti tényezők szerepéről sem. Jelentőségüket alátámasztja, hogy a megegyező genetikai állományú egypetéjű ikrek esetében korántsem biztos, hogy mindketten megbetegszenek. A pikkelysömört befolyásoló környezeti hatások között megtaláljuk a stresszt, a helytelen táplálkozási szokásokat és a kisebb-nagyobb mechanikai sérüléseket.
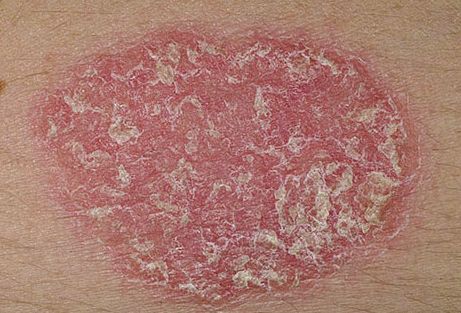
Az utóbbi években több vizsgálat célozta meg azoknak a faktoroknak a megismerését, amelyek elindítják a pikkelysömörös bőrre jellemző kórfolyamatokat. Hogy mi módon tudjuk megvizsgálni ezeket az eltéréseket? Ehhez nyújthat segítséget egy rendhagyó kísérletes modell. A tipikus kísérleti elrendezésekben idáig az egészséges és a pszoriázisra jellemző tüneteket mutató bőrt hasonlították össze. Csakhogy a gyulladt, citokinekkel elárasztott pikkelysömörös bőrben rejtve maradnak azok a hibák, amelyek a „kezdő lökést” jelenthették a pikkelysömör kialakulása során. A kiváltó faktorok azonosítását lehetővé teszi viszont az a megközelítés, amely az egészséges bőrből származó mintákat a betegek látszólag egészséges, tünetmentes bőrterületeivel veti össze. Ezek a régiók ugyanis már hordozzák azokat a korai eltéréseket, amelyek később a hámsejtek és a T-limfociták funkciózavarához vezetnek.
Munkacsoportunk – Szabó Kornélia, Bata-Csörgő Zsuzsanna, Kemény Lajos, Széll Márta és a szerző, a SZTE ÁOK és a MTA-SZTE munkatársai – szintén ezt a módszert alkalmazta, amikor új, pikkelysömörre hajlamosító tényezőket próbált leírni. A vizsgálatokhoz egészséges önkéntesekből és középsúlyos pikkelysömörben szenvedő betegekből nyertünk bőrmintákat, melyekből szövetkultúrát hoztunk létre. Ezt követően mindkét csoport mintáit olyan T-limfocitákból származó, limfokineknek nevezett anyagokkal kezeltük, amelyekről az irodalmi adatok alapján ismert, hogy hozzájárulnak a hámsejtek kóros válaszreakciójához pikkelysömör esetén. A kezelés után RNS-t izoláltunk a leválasztott hámból, és azt átírtuk komplementer, azaz cDNS-sé. Ezt követően végeztük el a sajátos vizsgálatot: a cDNS-microarray-t, közkeletűbb nevén a DNS-csippel való elemzést, amely több ezer gén kifejeződésének párhuzamos vizsgálatát teszi lehetővé.
Jelátviteli ösvényeken
A kísérlet kiértékelése során először összehasonlítottuk az egyes géneknek a limfokinos kezelést megelőző, illetve az azt követő kifejeződését. Ezek után pedig kiválogattuk azokat a géneket, amelyek expressziója eltérően változott az egészséges és a pikkelysömörös, ám tünetmentes hámban a limfokinnal való kezelés hatására. A végső listába azok a gének kerültek be, amelyek legalább kétszeres változást mutattak és az egyes minták közti különbségek a statisztikai hibahatáron belül maradtak. Nos, ötvenöt gént és tizenegy olyan, eddig még le nem írt transzkriptumot találtunk, amelyek megfeleltek ezeknek a követelményeknek.
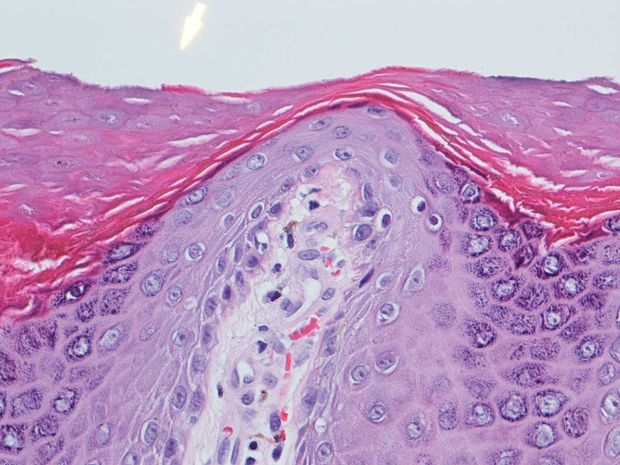
A géneket ezek után rendszerbiológiai módszerekkel jellemeztük – ezek segítségével arra kerestük a választ, hogy milyen módon rendezhetők hálózatba egymással a gének, és azok milyen funkciót töltenek be a hámsejtek életében. Kiderült, hogy legtöbbjük a sejtek sorsát meghatározó fő jelátviteli ösvényekhez (sejthalál, sejtosztódás és differenciálódás), illetve a kisméretű, lipid jellegű molekulák metabolizmusához kapcsolódik. Utóbbiak közismerten fontos szerepet töltenek be a gyulladás kiváltásában, éppen ezért a széleskörűen alkalmazott láz-, fájdalom- és gyulladáscsökkentő gyógyszerek is ezt az útvonalat célozzák meg.

Külön érdekesség volt, hogy három olyan gén is bekerült a listába – a serine/ arginine-rich splicing factor 18 (SFRS18), a peptydilpropyl isomerase G (PPIG) és a luc-7 like 3 (LUC7L3) –, melyek a mRNS érés- (splicing-) folyamatához kapcsolódnak. Ez idáig a mRNS-érés eltéréseiről ugyanis csak nagyon kevés publikáció látott napvilágot a pikkelysömörrel kapcsolatban. A splicing az eukarióta szervezetek génexpresszió-szabályozásának egyik legfontosabb eszköze, hiszen ennek folyamatnak köszönhetően egy génről többfajta RNS és fehérje is képződhet.

Magára a folyamatra számos szabályozó jellemző, ezek közé tartoznak a már említett, szerinben, argininben gazdag LUC7L3, SFRS18 és PPIG nevű fehérjék is. A fehérje-fehérje kölcsönhatásokat leíró STRING nevű adatbázis segítségével azt is megállapítottuk, hogy más splicing-regulátorok mellett az SFRS18- és PPIG-fehérjék interakcióba lépnek a pinin (PNN) nevű fehérjével is. A PNN – amellett, hogy a splicing szabályozásában szerepet játszó folyamatban részt – a sejt-sejt kapcsolatok megteremtéséért felelős dezmoszómák működéséhez is szükséges.
Erőteljesebben osztódnak
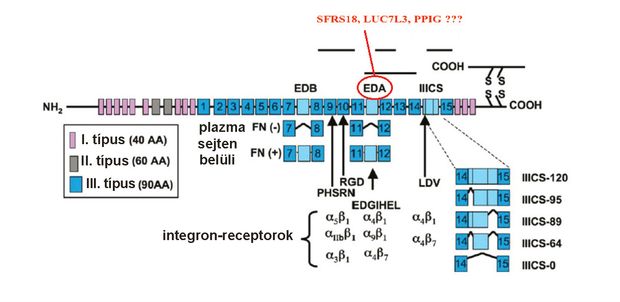
Kutatócsoportunk már korábban leírta, hogy a pikkelysömörben fontos szerepe lehet bizonyos splicing-defektusoknak. A közismert extracelluláris mátrixfehérje, a fibronektin egyik változata – az EDA+ fibronektin – is alternatív RNS-érésfolyamatoknak köszönhetően jön létre. Ez egy olyan többletdomént (EDA-domént) tartalmaz, amelynek hatására a szóban forgó fehérje erőteljesebben kötődik az integrin családba tartozó receptorához, ezáltal erősebb a receptorról induló sejten belüli jelátvitel is. Ennek következménye, hogy a hámsejtek másként reagálnak a környezetükből érkező jelekre, nagyobb mértékben osztódnak, sejtciklusuk felgyorsul. Pikkelysömörben szenvedők esetében a normális 28–30 nap helyett már 3–5 nap elegendő arra, hogy a hámsejtek a szarurétegbe jussanak. Az EDA-pozitív fibronektinről kutatócsoportunk bebizonyította, hogy nagy mértékben van jelen a betegek tünetmentes bőrében, és ott elősegítheti a hámsejt funkciózavarainak létrejöttét. A jelenleg is folyó kutatásaink során azt vizsgáljuk, hogy a három, általunk azonosított splicing-szabályozó vajon hatással van-e az EDA-pozitív fibronektinforma kialakulására.
A mRNS-érés pikkelysömörben tapasztalható zavarairól – említettük – rendkívül kevés tanulmány született, így egészen új megközelítésnek számítanak az ezzel kapcsolatos vizsgálatok. A betegséghez köthető splicing-rendellenességek megismerése elősegítheti a kórkép komplex molekuláris hátterének feltárását, és egyúttal újfajta terápiás megközelítéseket alapozhat meg. A témához kapcsolódó kutatásokra vélhetően nagy hatással lesz az újgenerációs szekvenáláson alapuló módszerek dinamikus fejlődése is. Az SFRS18-, PPIG- és LUC7L3-fehérjék vizsgálata ugyanakkor nemcsak a pikkelysömör kutatásban lehet segítségünkre, hanem a mRNS-érés szabályozásának pontosabb megértésében is.
SZLÁVICZ ESZTER
OTKA
K111885
K 105985
PUB-I 114496
2015/7





