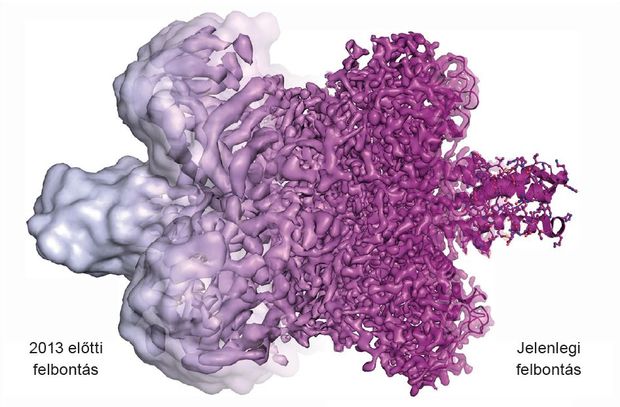
A kriogén elektronmikroszkóp (krio-EM) technológiának legfőbb szépsége abban rejlik, hogy amíg a mikroszkópok minőségét a készített kép felbontása jelzi, a krio-EM első pillantásra teljesen használhatatlan, homályos, alig kivehető képet ad, melyre úgy tűnik, hogy nem is érdemes több időt és energiát pazarolni. De az információ benne van. Másodjára ránézve, és bő tíz év fejlesztés és több kép együttes elemzése után, a maszatok alakot nyernek, és lassan körvonalazódni látszik egy nanométeres objektum. További tíz év fejlesztésének eredményeképpen ma már elég nagy magabiztossággal lehet behatárolni nem csak az atomok helyét, de a különböző pillanatnyi állapotába fagyott molekula funkcionális alakváltozásaira is fény derülhet.

A molekulák szerkezete és működése szorosan összekapcsolódik. Pillanatképek készítésével beleshetünk a molekulák életébe, amely végső soron a saját életünk. Az aktin végiglépked a miozinszálon, és a karunk felemelkedik. A topoizomeráz pördít egyet a DNS-szálon, és folytatódhat a másolás. Nátrium-csatorna nyílik az agysejtjeinken, és életre szóló elméknyomat marad belőle. Vagy mutálódik a DNS, és a belőle másolódó fehérje állandó aktív állapotban serkenti a sejtet osztódásra, és a tumor csak nő.
Éppen ezért a gyógyszerfejlesztés egyik nagy kérdése, hogy hogyan tudunk olyan hatóanyagot találni, amely kapcsolódik bizonyos fehérjékhez és ezzel semlegesíti vagy megváltoztatja a hatásukat. Ehhez segítségül hívjuk a fehérje alakját, és különböző algoritmusokkal olyan molekulát tervezünk, ami pont a megfelelő helyre illik, ahol szabályozni tudja a fehérje működését. Mindehhez szükségünk van a biológiai molekula alakjának vizsgálatára. Legjobb persze, ha az összes állapotát ismerjük egy adott molekulának, így tudjuk milyen, amikor aktív és milyen, mikor inaktív, de egyelőre rengeteg molekulát még egy állapotban se ismerünk.
Biológiai problémák
Fizikában, anyagtudományban évek óta nagy sikerrel használják az elektronmikroszkópot (1986, fizikai Nobel-díj), melynek alapelve, hogy egy nagy energiájú elektronsugárral illetjük a vizsgálandó anyagot, amely azzal valamilyen kapcsolatba kerül: szóródik, elnyelődik, áthalad vagy kilök egy elektront a mintából, amiből a minta alakjára, tulajdonságaira következtethetünk. Ezzel ma már egyes molekulákban az atomok helye is meghatározható. A biológiai minták vizsgálatára azonban több okból nem optimális: egyrészt a nagy energiájú elektronok nagy része egyenesen áthalad a számára „ritkás” biológiai mintán, emiatt alacsony a kontraszt, vagyis nehezen kivehető lesz a kép. Ezt lehet javítani negatív festéssel, vagyis, hogy a minta környezete „sűrű” az elektronok számára. Sejtek vizsgálatakor a vizsgálandó részletet vagy molekulát is megfesthetik ilyen „sűrű” anyaggal, például ozmium-tetraoxiddal. Másrészt az elektronnyaláb ereje összemérhető az atomok közt lévő kovalens kötéssel, ami miatt a mérés alatt károsodik a mért biomolekula. Harmadrészt pedig a mérés vákuumban zajlik, ami távolról sem a természetes környezete sejtjeink molekuláinak, amelyek mindaddig valamilyen – többnyire vizes – közegben voltak. A vízelvonással drasztikusan megváltozhat a molekulák alakja, épp az, amit mérni akarunk. Ezen is segíthet a fent említett negatív festés, mely során a minta egy elektronok energiájával szemben ellenállóbb anyagba van ágyazva, amely vákuumban is megtartja az alakját – így védve és támogatva a benne rejlő mintát.
Jelenleg leggyakrabban használt módszer a biológiai molekulák struktúrájának vizsgálatára a röntgen krisztallográfia és a mágneses magrezonancia, melyeket már korábban érdemesnek tartott a bizottság a Nobel-díjra. A röntgen krisztallográfia nagy felbontású képet ad, de csak kristályos mintákon végezhető, amely állapot sok fontos molekula esetében nem elérhető. A mágneses magrezonancia kis méretű, vízben oldható molekulákról ad nagy felbontású képet, akár a molekula mozgásáról is szolgálhat információval.
Ebbe a körbe lépett be a krio-elektronmikroszkópia, mely nagy molekulákról ad egyelőre kis felbontású képet, de kristályosíthatósági vagy szimmetriai megkötés nélkül, sőt, a molekulák vízburkukat, természetes alakjukat is megtartják, valamint a mérés során keletkezett kár is minimalizálódik. A krio-EM népszerűsége és képfelbontása folyamatosan nő, de még van mit behozni a másik két módszerhez képest. Talán ezt is segíti az idei Nobel-díj.
Elektronsugárral átlőtt minták
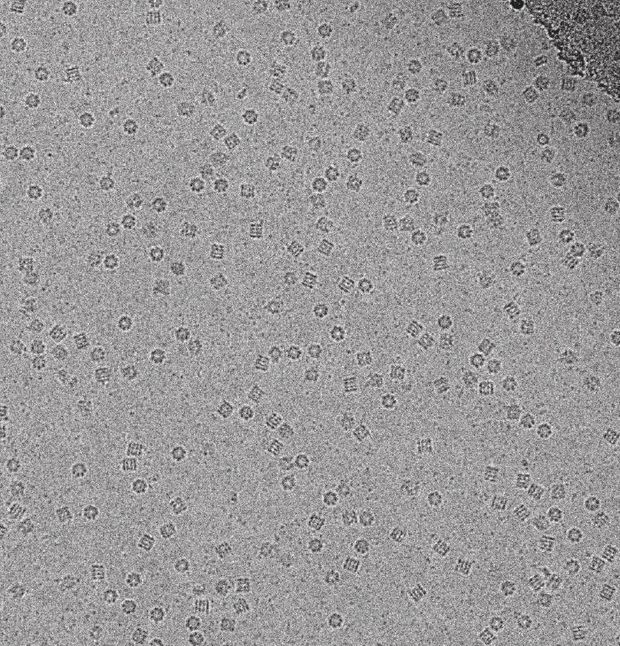
Miről is van szó? Vegyünk egy transzmissziós elektronmikroszkópot. Ez vékony mintán lő keresztül elektronokat és azok elnyelődésének és szóródásának mértékéből állapítja meg a minta alakját. A minta vákuumban van, mert a levegő atomjait nem szeretnénk mérni. Ha megpróbáljuk a biomolekulát ebbe vizes közegével együtt beletenni, a víz a vákuumban elpárolog. Ha lefagyasztjuk a vizet, akkor kevésbé párolog. Fagyasszuk le! Hűtés során a vízből jégkristályok alakulnak, amelyek szórják az elektronokat és tönkreteszik a molekulaszerezetet. Ahogy Jacques Dubochet fogalmazott: „a molekulák víz nélkül is és jégbe fagyva is halottak, mint a halak”. Fagyasszuk hát gyorsan! Ha a vizet hirtelen fagyasztjuk le, benne a molekulával, akkor a vízmolekuláknak nincs idejük kristályrácsba rendeződni, ott fagynak meg, ahol épp voltak. Az ilyen üvegszerű (vitrifikált) vízjég már egyenletesen szórja az elektronokat, nem zavarva a mérést. A lefagyasztás során -190 °C kell ahhoz, hogy a vízmolekulák ne rendeződjenek át kristályrácsba, -160 Celsius-fokon kell tartani. Ehhez a technikai feltételek együtt fejlődtek magával a mikroszkóppal. Jacques Dubochet, Alasdair McDowall és munkatársaik voltak az elsők, akiknek ez sikerült. Dubochet-t tüntették ki a 2017-es év kémiai Nobel-díjának harmadával.
Ahogy már fentebb szó volt róla, az elektronmikroszkóp elektronnyalábja szétveri a kovalens kötéseket. Ha viszont kevesebb, kisebb energiájú elektronnal pásztázzuk a mintát, az a képminőségen fog rontani. Ezt két módon lehet kiküszöbölni: egyrészt érzékenyebb detektorok segítségével is lehet még javítani a kép felbontásán. Ez a technológia fejlődésével érkezett, a mai műszerek egy-egy elektron detektálására is képesek. A 70-es években azonban ez még nem volt elérhető. A másik lehetőség, hogy sok képet kell készíteni, amelyeket aztán átlagolunk. Valójában a hagyományos mikroszkópok esetében is átlagolódik a kép a beérkező fotonok, elektronok vagy röntgensugarak alapján. Ha sok képet készítünk, mindegyik kép fog mutatni valamit a molekulából, amely a detektor előtt van, de hol ilyen, hol olyan szögből, hol az egyik, hol a másik részletet.

Ez önmagában nem probléma, a röntgen krisztallográfia során is mozgatjuk a mintát vagy a röntgennyalábot, hogy minden irányból megnézhessük a mintát, így alakítva háromdimenziós képet. Fontos, hogy itt tudjuk, hogy mikor melyik irányból nézünk rá a molekulára. Viszont a krio-EM esetében a minta egyenletesen van elszórva, vízbe fagyva egy rácsfelületen. Minden egyes rácspontban lesz egy molekula, amit vizsgálunk. Ezeknek a molekuláknak az irányultsága esetleges lesz: minden egyes molekula úgy áll, ahogy éppen megfagyott. És ez már egy sokkal komolyabb matematika-számítástechnikai probléma, hiszen az egyes képek felbontása gyenge. Ahogy Joachim Frank fogalmaz a cél „zajos háttér előtti, alig látható jellemzők egymáshoz illesztése”. Ezek külön-külön is komoly nehézségeket támasztanak a képfeldolgozásban. A kortársak egyenesen „maszattannak” („blobology”) nevezték a módszert.
Megoldások régen és most
A 1970 és ’80-as években Frank és Marin van Heel a következőképpen fogta meg a problémát. A rácsháló egyes pontjain elhelyezkedő molekula reprezentálható n darab különböző intenzitású pixellel, amely pixelek sokdimenziós vektorok. Ezeket a vektorokat többváltozós statisztikai analízissel csoportosítani lehet, mely csoportok megfeleltethetők az adott molekula adott orientációból vett kétdimenziós vetületeinek. Az azonosnak vélt orientációkból vett képek már átlagolhatók, így javítva a jel-zaj arányon. Ezen kétdimenziós átlagok megfelelő összerendezésével összeállítható egy háromdimenziós struktúra. Egyrészt meg kell találni az egyes vetületekhez tartozó szöget, másrészt össze kell rendezni azokat. Frank és Michael Radermacher megtalálták a megoldást. Ez a módszer megadja a lehetőséget arra is, hogy egyazon molekula különböző szerkezeti funkcionális állapotát is megkülönböztethessük. Frank a 2017-es kémiai Nobel-díj második harmadának kitüntetettje.
Richard Henderson és munkatársai tíz évvel később elsőként írták le a bakteriorodopszin molekulaszerkezetét a krio-EM segítségével. A rodopszinok családjában olyan tagok vannak, mint a gerincesek szemének fényérzékelő molekulái vagy mint a növények fotoszintézisének fénygyűjtő molekulái. A bakteriorodopszin a sejthártyában lévő molekula, s mint ilyen, nem kristályosítható önmagában struktúravesztés nélkül, szüksége van a membránra, hogy felvehesse működőképes alakját. A krio-EM ezt a lehetőséget megadja neki. Funkciójának és szerkezetének megfejtésével tudjuk, hogy a molekula fény hatására elektronokat mozgat a hártya egyik oldaláról a másikra. Ezt a tulajdonságát például az idegsejtkutatásban használják, segítségével fényre aktiválható idegsejteket lehet előállítani. Ez volt tehát az első molekula, amelynek a meg lehetett határozni a szerkezetét fagyasztási eljárás és a vetületátlagoló algoritmusok a segítségével. Henderson sürgette a mikroszkópok és előkészítési technológiák további fejlesztését, melyek korlátozták a felbontóképességet. Mindezen munkásságáért a 2017-es kémiai Nobel díj harmadik díjazottját tisztelhetjük benne.
A világ számos pontján zajlanak mérések a krio-EM technológia segítségével. A Stockholmi Egyetem egyik csoportja a mitokond-riumnak, a sejtek energiatermelő egységének teljes fehérjeszintetizáló apparátusát igyekszik megérteni. A módszer lehetőséget ad egy olyan komplex, rugalmas és dinamikus rendszer vizsgálatára, amilyen maga az élet.
A Nobel-díj, a világ talán legrangosabb, de mindenképpen a társadalom által legismertebb kitüntetése. A tudományos felfedezések megismerése és elismerése szerves része a társadalomnak. A tradíció és a megújulás szükséges ahhoz, hogy ez így is maradjon. Alfred Nobel végrendelete szerint a díj azt a személyt illeti meg, aki a megelőző évben az emberiség legfőbb javát szolgálta. Ez azóta enyhült és az időbeliség nem kritérium, valamint három személy is osztozhat a díjon, sőt a béke Nobel-díj esetében szervezetek is kaphatják. A tudományos társadalom ösztönzi a Nobel-díj gondnokait, hogy ezt terjesszék ki a természettudományokra is, hiszen a tudomány a „legcsapatabb csapatsport”. Alaposan kell keresni, hogy olyan tudóst találjunk ma, aki szólóban ért el tudományos áttörést. Jelenkorunk tudományos laborjaiban, amelyek vezetőit általában díjazzák, ott van még a doktorandusz hallgató, a posztdoktor, a technikus, ott vannak az együttműködő laborok, a konferenciák, a publikációk. Ott van az intézet maga, mely lehetővé teszi a zavartalan kutatást és az alapítványok és a kormányok, amelyek finanszírozzák. Az idei kémiai Nobel-díj tudományos sajtóközleményében a kitüntetetteken kívül nem kevesebb, mint 18 nevet említettek meg és közel 90 publikációt idéztek.
FERENC KATA
2017/41





