Eheti interjúalanyunk, Lőrincz András a Magyar Tudományos Akadémia Természettudományi Kutatóközpontjának (MTA TTK) Anyag és Környezetkémiai Intézetében (AKI) dolgozik. Olyan kisméretű biológiai „csomagokkal”, azaz liposzómákkal foglalkozik, amelyek segítségével célzottan a rákos daganatokba lehet hatóanyagokat eljuttatni. Eredményeik hozzásegíthetnek olyan gyógyszerhordozók előállításához, amelyek segítségével hatékonyabbak lehetnek az alkalmazott gyógyszerek és jóval kisebbek lehetnek a kemoterápia mellékhatásai.

– Mi a célja a Biológiai Nanokémia Kutatócsoportnak, amelyben dolgozik?
– Missziónk orvosi alkalmazású nanopartikulumok, nanorendszereknek a preparálása, fejlesztése és jellemzése gyógyszerhordozás, illetve képalkotás céljából. A „nano” a milliméter egymilliomod részét jelenti – a gyógyszerhordozó partikulumok (részecskék) esetén a 40 és 120 nanométer közti mérettartomány fontos számunkra. Az ilyen méretű részecskék tudnak a passzív célzás során feldúsulni a daganatok belsejében.
– Milyen tudományterületek kutatói működnek együtt a csoportban?
– Kutatócsoportunk sok tekintetben egyedülálló, például abban, hogy interdiszciplináris kutatást végzünk, és nagyon sokféle tudományterület képviselteti magát. Vannak fizikusok, vegyészek, modellező matematikus, én pedig biológusként veszek részt a munkában. Szükség van a preparálás, a megpreparált nanopartikulumok karakterizálása mellett az adott hordozóknak a kipróbálására, illetve biológiai tesztelésére is.
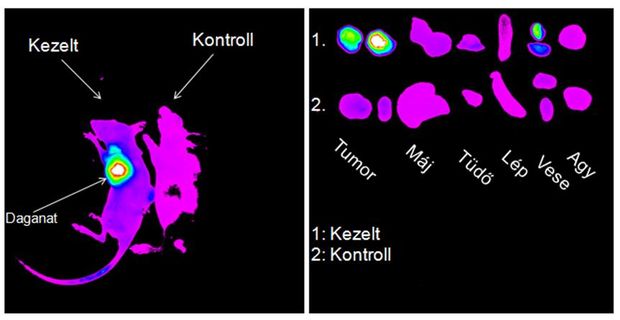
– Liposzómákkal dolgoznak. Mit jelent ez a kifejezés?
– A liposzómát egy foszfolipid-kettősréteg membrán által burkolt gömbként, zsákként lehet elképzelni, amelyeknek az átmérője 40 és 120 nanométer között van. Ezeket nagyon régóta ismerik és használják, például a kozmetikában. A gyógyászatban már több, mint 30 éve kutatják a liposzómákat, és ma is az egyik legjobban működő, legköltséghatékonyabb nanopartikulumokként tekintünk rájuk.
– A szervezetünkben is vannak ilyen részecskék?
– Igen, bár ezeket vezikuláknak hívjuk inkább.

– Önök pedig mesterségesen készítenek hasonló liposzómákat.
– Mesterségesen is, de a természetes vezikulákat is vizsgáljuk, például izolálunk sejtek által előállított úgynevezett exoszómákat. Az exoszómák nagyon hasonlóak a mesterséges nanoliposzómákhoz. Foszfolipid-kettősrétegből álló kis gömbök, melyeket membránjukban levő fehérjék stabilizálnak. Ez egy új paradigmát jelent a sejtek közötti kommunikációban. Kiderült ugyanis, hogy a sejtek ilyen exoszómákkal képesek egymás fehérjeszintézisét, jelátvitelét befolyásolni. Ezek akár gyógyszerhordozó célra is felhasználhatók. Sokat tanulunk az exoszómáktól, a természetes vezikuláktól abban a tekintetben, hogy hogyan kell jó biológiai célú gyógyszerhordozó nanoliposzómát, vezikulát létrehozni.
– Ön konkrétan azon dolgozik, hogy a liposzómákkal hogyan lehet a rákos sejtekhez eljuttatni a gyógyszert.
– Az ötlet nem új, már hosszú évek óta dolgoznak ilyesmin. Azonban tudni kell, hogy van még hova fejleszteni a liposzómákat. Olyan adalékanyagokat fejlesztünk, amelyek multifunkciós hatásúak. Elősegítik a liposzóma méretbeállítását, stabilitását, formulálását. Ezenkívül ennek az adalékanyagnak feladata lesz még az is, hogy növelje a gyógyszer hatékonyságát, illetve csökkentse a daganatsejtekre jellemző gyógyszer-rezinsztenciát is. Ezek a daganatellenes vezikulák az úgynevezett EPR-jelenség miatt képesek feldúsulni a daganatban.
– Mit takar az EPR kifejezés?
– Az Enhanced Permeability and Retention szavakból áll össze. Ez azt jelenti, hogy a daganatok ereket növesztenek a saját jobb tápanyagellátásuk érdekében. Ezek a daganatos erek kórosak. Az ereket belülről borító sejtrétegen, az endotélen nyílások vannak. A daganatban lévő erek áteresztőek a száz nanométer alatti tartományra, így a liposzómák át tudnak jutni rajtuk. Ugyanakkor az egészséges erek falán nem tudnak áthaladni. Emiatt a liposzómák döntően a daganatban fognak felgyűlni. Ezenkívül az egészséges szövetben van limfatikus elvezetés, azonban a daganatos szövetben nincs ilyen, illetve károsodott, így tehát ami bejutott az interstíciumba, azaz a sejtek közötti térbe a daganat belsejében, az jóval tovább képes ott is maradni. Ha valamilyen festékkel vagy más nyomkövető anyaggal megjelöljük ezeket a hordozókat, akkor nyomon tudjuk követni a hordozó úgynevezett biodisztribúcióját, azaz eloszlását a szervezetben, szövetekben.

– Egy vegyületet hogyan lehet célozni?
– Az EPR a passzív célzás alapja. Aktív célzásról akkor beszélhetünk, amikor a hordozót megjelöljük különböző molekulákkal, receptorligandokkal vagy ellenanyagokkal annak érdekében, hogy ezeket a hordozókat döntően a daganatos sejtek vegyék fel. Ilyen lehet például a folsav, ugyanis egyes daganattípusok a folsav-receptorokat nagy mennyiségben fejezik ki. Daganatra jellemző sejtfelszíni fehérjék ellen esetleg ellenanyagokat lehet felhasználni még a célzáshoz, amelyet a liposzóma felszínére köthetünk. Erre is van példa. A passzív célzás az maga az EPR.
– Hogyan magyarázza az EPR jelenségét a tudományban jelenleg uralkodó nézet, illetve miben vitatható ez az elképzelés?
– Az EPR-elképzelés azt állítja, hogy a daganatos erek átjárhatók, és hogy az endotélsejtek kapcsolatai meggyengülnek, ezért áteresztőek lehetnek. Azonban ha megnézzük a daganatok szöveti, akár elektronmikroszkópos képét, akkor sok daganat esetében egyáltalán nem találunk ilyen „ablakokat”, de feldúsulás mégis lehetséges. Ugyanakkor nem pusztán az endotélnek, hanem a bazális membránnak is áteresztőnek, lyukasnak kell lennie, illetve az a mögött lévő úgynevezett pericita rétegnek is. Ez pedig összességében már a hordozóhoz képest igen vastag réteg, amit a nanopartikulumnak át kellene, hogy járjon. Sok esetben ezt mikroszkópi képeken teljesen inertnek, egységesnek láttuk. Mégis lehet dúsulás, tehát más mechanizmusok is szerepet játszanak a feldúsulásban. A hordozó sok elvárásnak kell hogy megfeleljen hiszen azontúl hogy feladata a hatóanyag keringésben tartása és annak lokális célzása, önmagában a hordozó nem lehet toxikus, nem lehet immunogén (illetve ezeknek tolerálható szinten kell maradniuk), lehetőleg biológiailag lebomlónak kell lennie, és feladata elvégeztével ki kell ürülnie a szervezetből. Láthatjuk hogy a hordozófejlesztés sokrétű, számos kihívást rejtő feladat. Kollégáimmal azon dolgozunk hogy a kérdések tisztázásával hatékony és korszerű nanoméretű gyógyszerhordozókat hozzunk létre.
BAJOMI BÁLINT
2015/13





