A daganatok a legtöbb halálesetet okozó betegségek közé tartoznak. Mivel azonban nincs olyan betegség, hogy „a rák” és nincs olyan, hogy „a rák ellenszere”, igen nehéz a kutatók dolga. Nem csoda, hogy nagy erőkkel folynak e téren kutatások itthon és világszerte egyaránt. Az Óbudai Egyetem Élettani Szabályozások Csoportjában Sájevicsné Sápi Johanna egészségügyi mérnök és munkatársai új szemlélettel vizsgálják a problémát. Napjaink legígéretesebb módszere, a nanotechnológia is segíthet a megoldásban.

– Többféle végzettsége van, melyek egymástól elég távoli területeknek tűnnek. Melyik az igazi?
– Mindegyik, illetve ezek együttese. De igazából nincsenek olyan messze egymástól, hiszen mindegyikre szükségem van ahhoz, amit csinálok. Kiskoromtól orvosnak készültem, de mivel elsőre nem vettek fel az egyetemre, nővérként dolgoztam egy ideig. Közben jöttem rá, hogy több dolog is érdekel, és elvégeztem a SOTE egészségügyi ügyvitelszervező szakát, ami informatika, orvostudomány és gazdaságtan egyvelege. Ezután kerültem a BME-re egészségügyi mérnöknek, ott kezdtem a villamosmérnöki doktorit is. Amikor a konzulensem, Kovács Levente átment az Óbudai Egyetemre, és létrehozta az Élettani Szabályozások Csoportot, vele tartottam. Itt az Alkalmazott Informatikai és Alkalmazott Matematikai Doktori Iskolában szereztem meg a doktori fokozatomat. Mindig is érdekeltek ezek a határterületek. Érdekes, hogy apukám orvos lett, holott mérnöknek készült, nagypapám pedig mérnök lett, de orvosnak készült.
– Hogyan kapcsolódik az orvosi és a mérnöki terület a kutatási témájában?
– A tumorok ellen három klasszikus eljárás ismert: a kemoterápia, a sugárkezelés és a sebészet. A kemo és a sugár azonban nagyon sok mellékhatással jár, ezt mindenki tudja. Ezért célzott molekuláris terápiákat kezdtek kialakítani, hogy megkíméljék az ép sejteket, és valamilyen célzott mechanizmussal úgy hassanak a tumorsejtekre, hogy csak azok pusztuljanak el. Egy ilyen típus az antiangiogén terápia, amely az érképződés ellen hat. Arra a megfigyelésre épül, hogy a tumorok fejlődésük kezdetén alig 1-2 mm átmérőjűek. A helyi kapillárisokból fel tudják venni az oxigént és a tápanyagot. Ahhoz, hogy ténylegesen nőni tudjanak, saját érrendszerre van szükségük. Mindezt átkapcsolással, mutációval oldják meg, és innentől kezdve nőnek erek a tumorok felé, behálózva azokat. Ezt bimbózásos érképződésnek hívjuk. Erre a mechanizmusra épül a Hahnfeldt-modell, amelyet 1999-ben hoztak létre a Harvard Medical School-on. Ezt vizsgáltam az MSc-s diplomamunkámban. Viszont a legújabb orvosi kutatások szerint nemcsak bimbózásos érképződés létezik, hanem nagyon sok más is. Ráadásul, ha érképződésgátlót adagolunk, az a meglévő erekre nem hat, csak az éppen képződőkre. Ezért nem biztos, hogy azt kapjuk, amit a modell leír, vagyis hogy csökken a tumortérfogat.

A doktorim alatt két tumortípust mértünk a Semmelweis Egyetem Patológiai és Kísérleti Rákkutató Intézetében, elemeztük a növekedés dinamikáját, adagoltunk antiangiogén szert is. Az volt a célom, hogy új tumornövekedési modellt állítsak fel. Ez meg is történt, de statisztikai és matematikai módszerrel is próbálkozunk finomítani az eredményeket. Célunk az, hogy ha megvan a modell, zártkörű szabályozást lehessen létrehozni.
– Hogyan működik ez a modell, és hogyan lehet alkalmazni a valóságban?
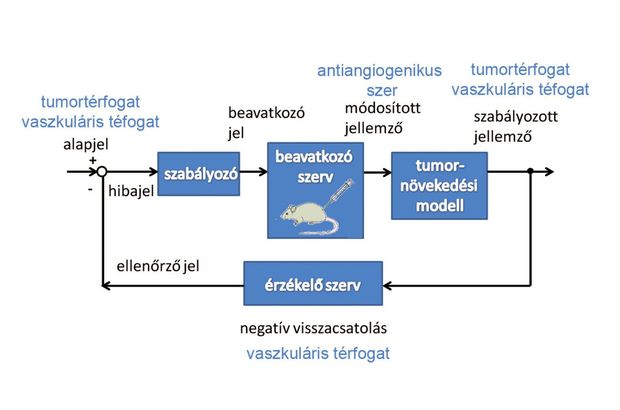
– Figyeljük a tumornövekedést és meghatározunk rá egy modellt, amely tulajdonképpen egy differenciálegyenlet-rendszer, ez reprezentálja számítógépes környezetben a tumornövekedést. A zártkörű szabályozás azt jelenti, hogy egy szenzor érzékeli az aktuális tumortérfogatot, és ha az a kívánt méretnél nagyobb, akkor egy szabályozó algoritmus olyan utasítást ad, miszerint antiangiogén szer adagolása történjen a tumor térfogatának csökkentése céljából.
A program Matlab-környezetben fut, szabályozókat és érzékelőket tervezünk bele, s a kapott jelek alapján megfelelő módon közbelép, adagol – akkor és annyit, ahogyan kell. Tehát tulajdonképpen egy irányítástechnikai problémát kell megoldani.
Hasonló problémára ad megoldást a „mesterséges hasnyálmirigy”. Az I-es típusú diabéteszeseknek nincs inzulintermelésük (vagy nem megfelelőn működik az inzulinfelhasználásuk), pedig ez létfontosságú ahhoz, hogy a sejtek fel tudják venni a cukrot a véráramból. Egy zárt rendszerű eszköz, amely inzulinpumpát is tartalmaz, méri a vér glükózszintjét, és adagolja a megfelelő mennyiségű inzulint, hogy se sok, se kevés ne legyen a vércukorszint. Ennek az analógiájára működne a miénk is. Az elméleti része tulajdonképpen készen van: a tumornövekedés dinamikáját identifikáltam, szabályozási algoritmusokat terveztem, a tumor mérését pedig például kisállatok MRI-jével meg lehet oldani. Ezek azonban csak offline adagolást tesznek lehetővé. A jövőben nanotechnológiával lehetne megoldani az online adagolást, mely célzottsága és szelektivitása révén várhatóan nagyon jól felhasználható. Ám ez csak egy lehetséges változat, a megvalósításnak még abszolút az elején vagyunk.
– Számít, hogy milyen típusú tumorról van szó és az hol helyezkedik el?
– Persze, ezek mind számítanak. Amivel eddig foglalkoztunk, azok szabad szemmel is láthatók, bőr alatt nőnek, mérni is egyszerűbb őket. Az is számít, hogy milyen típusú a tumor, mert különböző gyorsasággal nőnek.
Amely a szakirodalomban is található, az egy adott tüdődaganatra lett kimérve. Mi két tumorra végeztünk méréseket, ezek most még specifikusak. A cél azonban nyilvánvalóan az, hogy olyan tumornövekedési modellünk legyen, amely kellőképpen általános, hogy rá lehessen húzni a legtöbb dologra, ugyanakkor elég specifikus is. Nagyon nehéz kérdés, de ahogy említettem, még az elején vagyunk. A mi mérnöki megközelítésünk a világban is unikális dolog, bár az irányítástechnika sok helyen megjelent már élettani területeken is. A legkézenfekvőbb a diabétesz. A tumor azonban sokkal nehezebb probléma, sokkal bonyolultabb rendszer, nagyon sok változó van benne.
– Egerekkel dolgoznak, de a kapott eredményeket emberre is lehet alkalmazni?
– Ez sem egyszerű kérdés. Vannak daganatok, melyek hasonlóan működnek egereknél és embereknél is. Ilyen például a melanóma, amivel mi is foglalkoztunk. Eddig egérbe egérből származó tumort implantáltunk. Most indult egy kísérlet, ahol egerekbe humán tumort ültetünk, de ez még mindig csak egy köztes lépés. Embereken végzett kísérletet természetesen alapkutatásban nem lehet végezni, és sok dolog van, amely egereknél működik, embernél viszont nem. Sok ígéretes kísérlet bukott már meg ezen.
– Létezik általános, mindenféle daganatra jó megoldás vagy mindegyikre mást kell találni?
– Amitől mindig feláll a hátunkon a szőr, az olyan jellegű hírek, hogy megtalálták a rák ellenszerét, hiszen nincs olyan, hogy a rák és nincs olyan, hogy a rák ellenszere. A kifejlődött daganat ugyanis ezerféle lehet. Szerintem a legfontosabb a megelőzés, általánosságban az egészségünk érdekében és magában az egészségügyben is. Ezt látom célnak a tumorkezelésben is, ezért ebbe az irányba próbálunk menni. Azt is vizsgáltuk, mi van akkor, ha az adott szert nagyon korán kezdjük adagolni, amikor még nincs is tumor, hogy meg se tudjon eredni, vagy ha elkezdődött, ne tapadjon meg. Ha akkor avatkozunk be, amikor a daganatok még nem mutatnak specifikációt, talán lehet majd egységesen kezelni őket. Az azonban biztos, hogy minél közelebb vagyunk a tumor kialakulásához, annál kevésbé differenciált a sejt, annál nagyobb esélyünk van arra, hogy valamilyen általános, preventív módszert használjunk.
TRUPKA ZOLTÁN
2015/31