Ron Richarchds, az ausztráliai Newcastle-ben élő középkorú férfi igazán szerencsésnek mondhatja magát, legalábbis biztosan közel volt az őrangyala, amikor néhány hónappal ezelőtt éppen az egyik legkiválóbb ausztrál sürgősségi-baleseti kórház szomszédságában ütötte el egy 60 km/h sebességgel hajtó autós. Számos töréssel, belső sérüléssel szállították az osztályra, ahol nem sokkal később a szíve is leállt, ám a nagyszerű orvosi csapatmunkának köszönhetően sikerült újraéleszteni és stabilizálni állapotát… Egy rövid ideig.
Néhány nappal később ugyanis hirtelen és drasztikusan romlani kezdett az állapota, a szervei egytől-egyig elkezdtek leállni. Mikor már sem a mája, sem a tüdeje, sem a veséi nem működtek megfelelőképpen, az orvosoknak nem volt kétségük afelől, hogy a férfi úgynevezett szisztémás gyulladásos válaszreakciótól szenved, amelynek legsúlyosabb és gyakran végzetes következménye a többszervi elégtelenség. Ez a tünetegyüttes felelős nagyon sok ember haláláért a kórházakban, hiszen jól ismert, hogy a fekvő betegeket ért bakteriális fertőzések gyakran vezetnek szepszishez, amely sok esetben szintén a szervek együttes leállásával ér tragikus véget.
Ám míg a „vérmérgezés” esetében a véráramba bekerült kórokozók felelősek a súlyos tünetekért, felmerül a kérdés, hogy mi válthatja ki ugyanazokat az immunrendszer aktiválódásával járó károsító reakciókat, ha nincs jelen patogén a szervezetben? Hiszen egy gázolás során elvileg nem fertőződik meg a páciens, amennyiben nem egy humán patogéneket szállító járműről van szó, ráadásul a világon regisztrált többszervi elégtelenség elszenvedői között nagy arányban találhatunk égési sérülteket, valamint golyóütötte sebbel kórházba került betegeket is. Vajon hol lehet a közös pont egy szeptikus páciens és egy traumás sérült immunrendszerének aktiválódásában? A másik, alapvető kérdés pedig maga az immunrendszer „barát vagy ellenség” jellegéből adódik, tehát mi veszi rá természetes védekezőrendszerünk elemeit, sejtjeit arra, hogy ellenünk, saját szervezetünk ellen forduljanak? S egyáltalán hogyan képes egy patogénekkel fertőzött szervezet eltúlzott, káros immunválaszra?
A válaszok keresése előtt először szót kell ejtenünk röviden az immunvédelem és a fehérvérsejtek legfontosabb tagjairól, a káros folyamatokért leginkább felelős sejtekről. A fehérvérsejtek 2/3-át alkotó neutrofil granulociták-nak rendkívül szerteágazó a szerepkörük a fertőző mikroorganizmusokkal szemben való küzdelemben. A gyulladásos válasz aktivációját követően ezek a sejtek a véráramból a fertőzés helyére vándorolnak, ahol elsősorban fagocitózis útján megsemmisítik a patogéneket, a bennük található proteolítikus enzimek segítségével. Exogén szekréció útján pedig különféle antimikrobiláis faktorral, valamint saját enzimeik segítségével termelt reaktív oxigéngyökökkel vesznek részt a további harcban. Emellett számos olyan további ágenst, jelátviteli útvonalat is képesek aktiválni – illetve ezek révén további résztvevőkkel kommunikálni –, amelyek tovább gerjesztik az említett eseményeket, így a válaszreakció egy idő után kontrollálatlanná válik, túlzott mértékű oxido-reduktív stressz lép fel a szövetekben, amelynek az arra leginkább érzékeny szervek fognak áldozatul esni. Ilyenek a nagy oxigénigénnyel rendelkező, valamint a lebontó folyamatokért felelős szervek, amelyek mitokondriumokban rendkívül gazdagok. Amennyiben nem sikerül időben észrevenni a kórokozók jelenlétét, néhány nap alatt felléphet a többszervi elégtelenség.
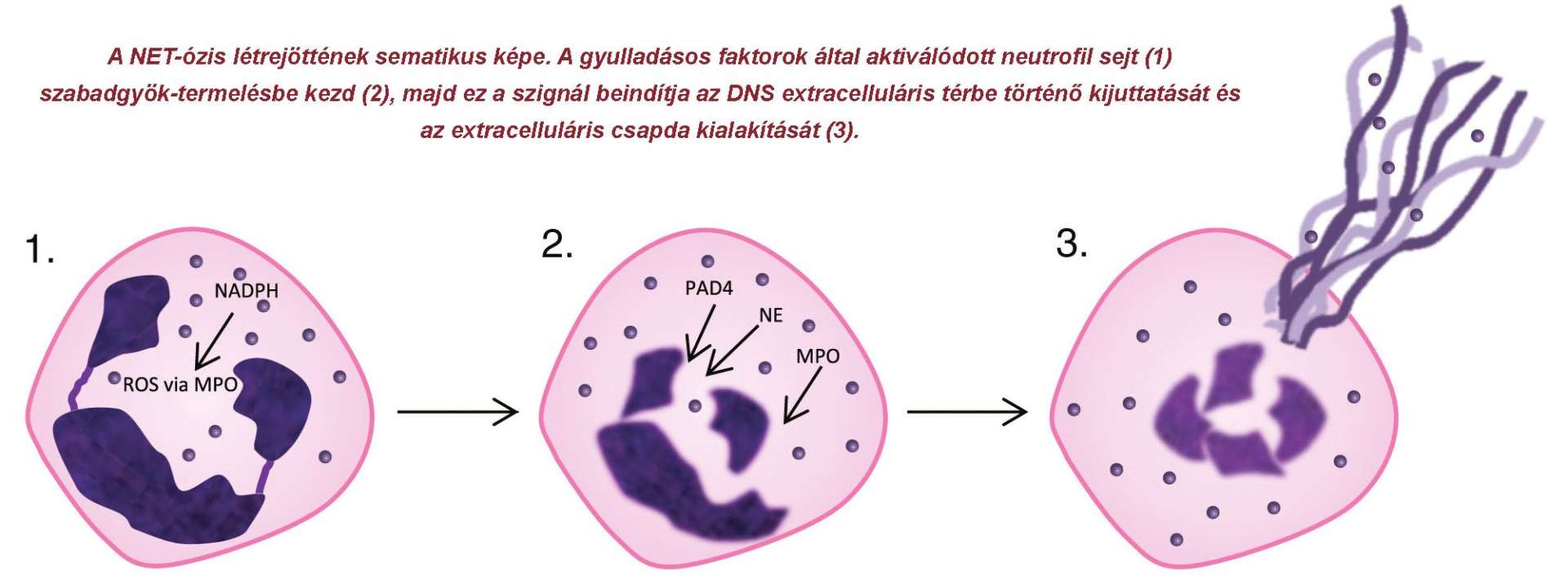
Néhány évvel ezelőtt egy további, egyedülálló védekezési szerepkört is azonosítottak, amellyel a neutrofilek hatékonyan pusztítják el a patogéneket. Ez a neutrofil extracelluláris csapdák (NET) létrehozásának képessége, amellyel csak a már aktivált neutrofilek rendelkeznek. A NET képzése során a nukleoszóma az aktivált sejtből az extracelluláris térbe kerül, ahol a hisztonfehérjék aktív közreműködésével egy DNS-alapú váz képződik, számos proteinnel, vezikulummal kapcsolódva, amelyek proteolítikus vagy éppen további szabadgyököket generáló hatásukkal elpusztítják a betolakodót. Magát a folyamatot nevezzük NET-ózisnak, az apoptózis után szabadon, hiszen a NET-et képzett neutrofilek általában a programozott sejthalálhoz hasonlóan elpusztulnak. A jelenség valószínűleg evolúciósan igen konzervált, egyaránt kiváltja Gram- és Gram+ baktériumok, valamint különféle vírusok és gombák jelenléte. Fontos tudni róla, hogy a NET képződése pozitív visszacsatolást is kivált, azaz egy NET kialakulása stimulálja a további NET-ózist. De vajon mi a helyzet az általunk ismertetett esettel, ahol nem fertőzés miatt került a páciens intenzív osztályra?
Jelentősebb traumás sérülés kezelésében kulcsfontosságú lehet az időben elvégzett sebészi terápia, amelynek kórokozók jelenléte nélkül is gyakori következménye lehet az említett válaszreakciók aktiválódása, ilyenkor beszélhetünk steril gyulladásokról. Mind a celluláris, mind a molekuláris események bekövetkeznek ilyenkor, s célzott kezelés nélkül néhány nap alatt kontrollálatlanná válhatnak, ahogyan ez a cikkünkben szereplő férfinál is 3-5 nap alatt bekövetkezett. A Newcastle-i kórházban kimutatták, hogy a beteg állapotromlásának hátterében feltehetően a NET-ózisból adódó másodlagos gyulladásos szövetkárosodás áll, hiszen a beteg véréből nagy mennyiségű NET-et lehetett kimutatni. A pontos mechanizmus nem ismert, ám hasonlóan más munkacsoportokhoz, ők is leírták, hogy reaktív oxigéngyökök felszabadulása – azaz oxidatív robbanás – nélkül elmaradt a nagymértékű NET-képződés.
A közös pont pedig egy már említett, esszenciális sejtalkotó lehet, amely normál állapotban a minden életműködés fenntartásához szükséges energia megtermeléséért felelős. A mitokondriumok eredetét tekintve manapság már teljesen elfogadott az úgynevezett endoszimbionta-elmélet, amely szerint egy ősi, alpha-proteobacteria endocitózissal történő bekebelezése útján kezdődött az „élete” – sejtszervecskeként. Erre utalnak külső és morfológiai jegyei, valamint DNS-ének (mtDNS) a nukleáristól (nDNS) különböző, kizárólag baktériumokra jellemző sajátosságai. Cirkuláris genetikai állománya kevésszámú, mindössze 16 kódoló gént tartalmaz, amelynek mindegyike esszenciális, az elektrontranszport-láncban hasznosuló fehérjét kódol. Nem működnek benne hibajavító mechanizmusok, emiatt mutációs rátája legalább 10-szer nagyobb, mint a nDNS-é.
Nemrég arról számoltak be kutatók, hogy a mtDNS bakteriális jellege nemcsak a hozzá köthető megbetegedések és a terápia szempontjából lényeges, sokkal inkább az immunrendszerben betöltött komoly szerepére érdemes odafigyelni. Igazolták, hogy súlyos sérülést, traumát szenvedett betegek vérében jelentős a mtDNS koncentrációja, amely összefüggésben áll a traumát követően fellépett szisztémás gyulladásos válaszreakció (SIRS) súlyosságával. Ez a felfedezés pedig, mivel patogének nem voltak a betegek szervezetében, a mitokondriális DNS-t tette felelőssé az immunrendszer aktiválódásáért, mivel a sérülés-asszociált mintázatfelismerő receptorok számára ugyanolyan szignált jelentett, mint a bakteriális DNS jelenléte. Ez a receptor-
aktiváció pedig ugyanúgy beindítja a klasszikus gyulladásos kaszkádot, mint a patogén-asszociált útvonal.
Visszatérve Ron Richarchdsra, ezt alátámasztandó, hogy a vérében nemcsak NET jelenlétét, hanem nagy mennyiségű extracelluláris mtDNS-t is találtak az ausztrál kutatók, míg bakteriális és nukleáris örökítőanyag ugyanott nem volt kimutatható. Ennek alapján már egyértelmű volt a számukra, hogy valóban káros gyulladásos válasz okozta a súlyosbodó állapotot, amelyet nem patogének váltottak ki, így hatékonyan fel tudták venni a harcot a tünetegyüttessel szemben. Ron nemsokára jobban lett, és a felépülést követően ő maga nyilatkozta, hogy valóban milyen szerencsés ember. Az ő esetéből pedig az egész világot bejáró szenzációs felfedezés született, hiszen elsőként sikerült a magyar Balogh Zsolt professzor által vezett Newcastle-i kutatócsoportnak vizualizálni a NET-eket traumás sérülést szenvedett beteg vérében.
TUBOLY ESZTER
2015/11