Az emberi agy közel 85 milliárd neuront tartalmaz, de a kutatásokhoz használt modellállatok, az egér vagy a patkány agyában is közel 100 millió neuron található. Az emlős agy működése alapvetően ezen idegsejtek szinaptikus kapcsolatára épül. Az idegsejtek számát jóval meghaladja a közöttük kialakuló kapcsolatok mennyisége: az agy fejlettségének függvényében akár 10ˇ211–10ˇ14-en számú kapcsolat is található az idegsejtek között.
Egy agykérgi nagy piramissejt akár több ezer szinaptikus „bemenetet” fogadhat. Ha számításba vesszük az idegsejtek bonyolult nyúlványrendszerét, valamint azt, hogy a rájuk érkező kapcsolatok nemcsak a fogadó nyúlványok (dendritek) felszínén oszlanak el változatosan, hanem aktivitásuk még időben is eltér egymástól, akkor egy rendkívül bonyolult hálózat tárul elénk. Ebben a hálózatban igen komplex feladat hárul egy-egy idegsejtre a neuronális információfeldolgozás során.
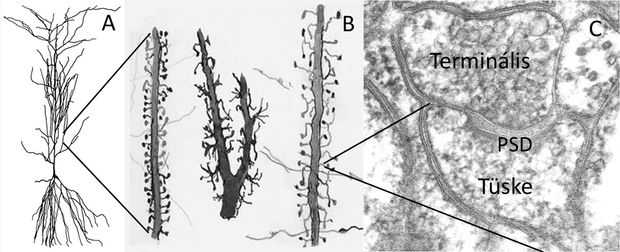
(FORRÁS: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTÍFICAS, INSTITUTO RAMÓN Y CAJAL)
Szerencsére ezzel a roppant feladattal nem teljesen segítség nélkül kell megbirkóznia az idegsejteknek. Az emlős előagyi ideghálózat mintegy 90%-a serkentő működésű, vagyis a szinaptikus kapcsolatok ingerülete átterjed a posztszinaptikus partnerre. A serkentő axonterminálisok döntő többsége – amelyek jelátvivő anyaga az apró vezikulákba csomagolt aminosav, a glutamát – azonban nem közvetlenül az idegsejtek nyúlványainak sima felszínén, hanem azok apró kitüremkedésein, úgynevezett dendrit-tüskéken végződnek. Ezek a tüskék apró, a beérkező ingerület-feldolgozásra specializálódott, önálló biokémiai „mikroszámítógépek”, amelyek alapvető szerepet játszanak az általuk fogadott szinaptikus aktivitás feldolgozásában és továbbításában a dendrit-törzs, illetve a sejttest felé. Jelenlétükre már Ramón y Cajal is felfigyelt, és csodálatos rajzain meg is örökítette azokat. Cajal még nem tudhatta – hiszen az 1900-as évek elején még nem létezett elektronmikroszkóp – hogy ezek a tüskék valójában az ingerület feldolgozására és közvetítésére szakosodott dinamikus kapcsolatok.
A figyelem fókuszában
A dendrit-tüskék régóta a tudományos figyelem fókuszában állnak. Megállapították, hogy méretük és szinaptikus hatékonyságuk igen szoros összefüggést mutat. A tüskék térfogata önmagában meghatározza a posztszinaptikus receptív felszín (a posztszinaptikus denzitás) méretét, a glutamát receptorok számát és a preszinaptikus ingerületre adott válasz magnitúdóját: nagyobb tüskék több receptorral rendelkeznek és hatékonyabb szinaptikus ingerületátvitelre képesek. Az olyan stimulusok, amelyek tartós szinaptikus hatásnövekedést képesek kiváltani – amelyet egyébként a tanulás és memória idegrendszeri alapfolyamatának is tekintünk – tüskeméret növekedéssel és több glutamát receptor szinapszisba helyeződésével, míg a tartós szinaptikus hatáscsökkenés tüske-zsugorodással és receptor-szám csökkenéssel járnak. A receptorok szállítását a tüskén belül szelektív ún. endoszóma rendszer végzi. A tüske-szinapszisok alakja tehát nem állandó, a szinapszisok molekuláris változásait szorosan követik a tüskék morfológiájában bekövetkező változások.
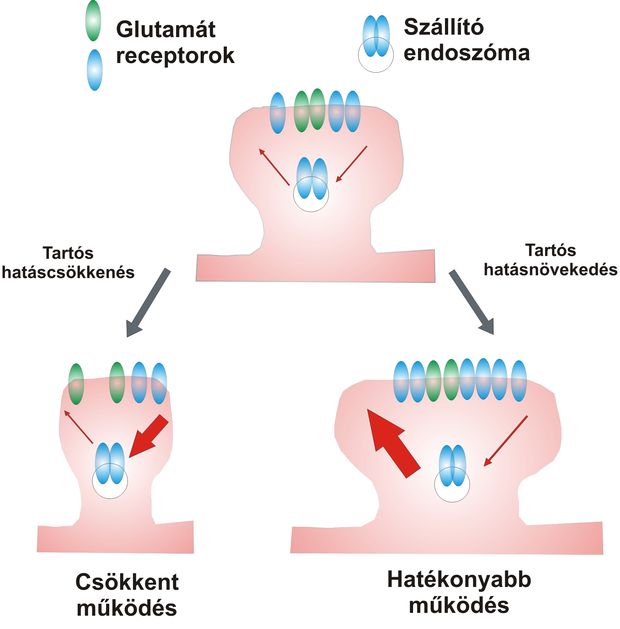
A neuronális jelátvitelben sarkaltos szerepet játszó tüskeszinapszisok alakját a bennük található dinamikus vázrendszer, az aktin citoszkeleton határozza meg. Az aktin egy globuláris monomerekből (G-aktin) enzimatikus szabályozófehérjék segítségével fonalakká polimerizálódó (F-aktin) mikrofilamentum típus, amely evolúciósan igen konzervált módon egyaránt jelen van az egysejtűekben és a legfejlettebb emlősök sejtjeiben, így az idegsejtekben is. Az idegsejtek felszínén található tüskék aktivitás-függő morfológiai változásának alapjául is az aktin-hálózat dinamikus átépülése áll. Ez az ún. aktivitás-függő aktin reorganizáció igen komplex kapcsolatra utal az idegi impulzusokat közvetlenül felfogó glutamát-receptorok és az aktin-alapú „tüskeváz” között.
A dendrit-tüskék számos speciális feladat ellátását végző funkcionális területtel, úgynevezett doménnel rendelkeznek. Ilyen például a már korábban említett posztszinaptikus denzitás, amely a jelátvivő anyag glutamát-érzékelését végző receptorokat és a hozzájuk tartozó jelátvivő és struktúr-fehérjéket tartalmazzák. A receptorok és sejtfelszíni molekulák transzportjáért felelős területek is megtalálhatóak a tüskék felszínén: az úgynevezett endocitotikus és exocitotikus zónák feladata a transzportfolyamatok helyének kialakítása és a szállítási folyamatok irányának meghatározása, a szállító endoszómák létrehozása és dokkolása. Ezért arra voltunk kíváncsiak, vajon a tüskék alakját meghatározó aktin-hálózat is rendelkezik-e hasonló „domén”-szerkezettel, hiszen feltételezhető, hogy az idegi aktivitás nem véletlenszerűen polimerizálódó és átalakuló, hanem egy nagy rendezettséget mutató vázrendszerre támaszkodik.
Véletlenszerűen vagy koncentráltan?
A szinaptikus dendrit-tüskék parányi mérete (0,02-0,03 femtoliter, 1 fL 10-15 liternek felel meg) azonban nem teszi lehetővé a bennük található aktin-hálózat hagyományos fénymikroszkópos technikákkal való vizsgálatát. Az elektronmikroszkópban (melynek felbontóképessége ~0,2 nanométer) már láthatóak a szinaptikus partnerek, de a tüskék plazmájában mindössze egy többé-kevésbé heterogén, fonalas szerkezetet mutató aktin-hálózat figyelhető meg, amely nem visz közelebb a tüskeváz szerkezetének megértéséhez. Megfelelő technikával azonban meg tudjuk jeleníteni a különböző funkcionális állapotban lévő aktin-doméneket. Ehhez az aktin-váz azon tulajdonságát használjuk fel, miszerint a G-aktin monomerek önállóan nem képesek sem fonalakká polimerizálódni, sem a fonalak bonyolultabb hálózattá alakulni, mivel ezek igen energiaigényes folyamatok és megfelelő biokémiai katalizátorok – enzimek – nélkül nem mennek végbe. Az aktin-hálózat szabályozott és dinamikus kialakításáért egész enzimrendszer felelős, ma már sok ilyen, specifikus funkciókkal rendelkező fehérjét ismerünk. Jellemző rájuk, hogy szinte minden sejtben megtalálhatóak, és az aktinhoz hasonlóan az evolúció során sem szerkezetileg, sem funkciójukban nem, vagy csak alig változtak. Például a legtöbb eukarióta-sejtben a cofilin nevű enzim a fonalak darabolásáért, depolimerizációjáért felelős, míg az úgynevezett Arp2/3 komplex – amely egy hét alegységből álló multimer enzim – a filamentumok felszínén hoz létre elágazódásokat, majd képes az új filamentum polimerizációjára, nukleációjára. De léteznek a filamentumokat kötegekbe rendező, keresztkötéseket létrehozó, monomereket szállító és fonál végéhez kötő specifikus enzimek is.
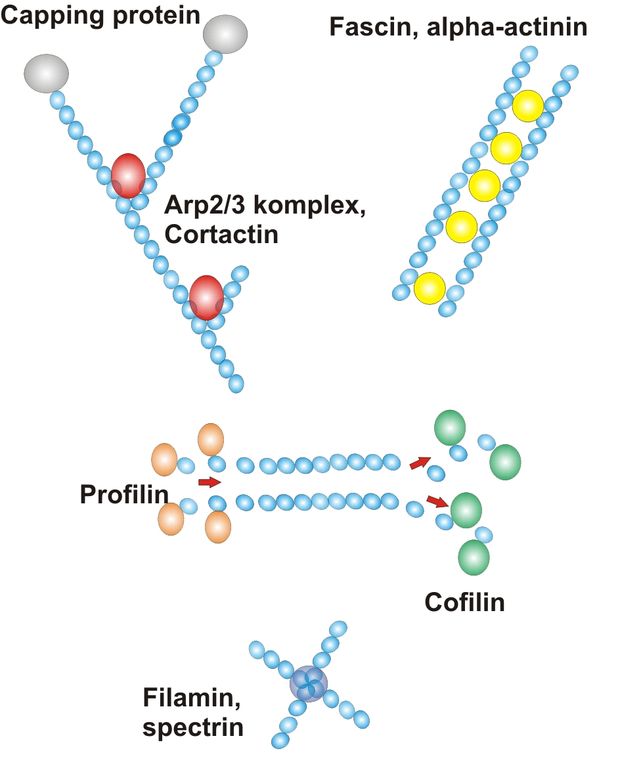
Az aktin-szabályozó fehérjék ezen tulajdonságát felhasználva megvizsgáltuk, hogy az egyes fehérjék a tüske-plazma mely területén fordulnak elő: vajon véletlenszerűen oszlanak meg az egyes funkciót hordozó enzimek, vagy bizonyos területeken koncentrálódnak? Ehhez megjelöltük az egyes fehérjéket olyan módszerrel, amely jól látható jelet ad az elektronmikroszkópban, és elég kicsi ahhoz, hogy az adott enzim helyét megmutassa: agyból készült metszeteket a vizsgálni kívánt fehérje ellen termelt olyan ellenanyaggal (antitesttel) inkubáltuk, amelyekhez néhány nanométer átmérőjű, kolloidális aranyszemcse volt kötve. Természetesen sok ezer tüskén belül egy sereg aranyszemcse helyzetét kell pontosan megmérni és úgynevezett kvantitatív statisztikai módszerrel feldolgozni. Az adatok feldolgozása egyértelműen kimutatta, hogy az aktin alapú tüskeváz szabályozásában alapvető szerepet játszó egyes fehérjék egymástól elkülönülten koncentrálódnak. A korábban említett depolimerizáló hatású cofilin közvetlenül a membrán alatti régióban, egy héjszerű területen fordul elő. Az Arp2/3 komplex a tüske-plazmán belül egy gyűrű – pontosabban fánk – alakú területen található a legnagyobb mennyiségben, míg például a cortactin, amelyik stabilizálja a filamentum-elágazódásokat, a tüske középpontjában lokalizálódik. E példák alapján is látható, hogy az aktin-átalakítási funkciók elkülönült helyeken, úgynevezett mikro-doménekben találhatóak. Már korábban feltételezték az aktivitás-függő szinaptikus tüske-morfológiai változások alapján, hogy a tüskék felszíne sokkal dinamikusabb, míg a középpontban egy stabilabb aktin-mag található. Ezt a feltételezést a mi vizsgálataink is messzemenőkig alátámasztották, hiszen a stabilizációért felelős fehérjéket a tüske középpontjában találtuk, a dinamikusabb aktin-hálózatért felelős cofilint pedig épp a tüske felszíne alatt. A tüskékben tehát nagyon magas rendezettségű biokémiai szegregáció, úgynevezett kopartmentalizáció támogatja a hatékony neuronális jelátvitelt. Az ingerület továbbításáért felelős jelátviteli rendszer szorosan összekapcsolódik az aktin citoszekeleton szabályozásáért felelős enzimekkel, létrehozva ezzel az aktivitás-függő szinaptikus plaszticitás morfológiai alapjait is.
Precíz gépezet
Amennyiben e rendezettség hátterében található enzimrendszer vagy szabályozása károsodik, az súlyos következményekkel jár. Abnormális dendrit-tüske morfológiát számos neuropszichiátriai kórkép, például értelmi fogyatékosság, skizofrénia vagy autizmus esetében megfigyeltek már. Egyre több bizonyíték utal arra, hogy az idegsejtekben található aktin-sejtváz szabályozási útvonalaiban bekövetkező hibák és ezen kórképek között közvetlen kapcsolat lehet. Számos skizofrénia-kórképben találtak olyan enzimdefektust, amely egyértelműen a dendrit-tüskékben zajló aktivitás-függő aktin reorganizáció enzimrendszerét érinti. A tüskékben található intermedier jelátvivő molekulák családjába tartozó, úgynevezett Rho GTPáz-fehérjék hibái (melyek a receptorok aktivitását közvetítik az aktin-szabályozó enzimek felé) is egyértelműen köthetőek az értelmi fogyatékossághoz vagy a skizofréniához. Mindezek arra utalnak, hogy a szinaptikus aktin-citoszkeleton hibás szabályozása számos idegrendszeri és pszichiátriai kórkép kialakulásáért lehet felelős.
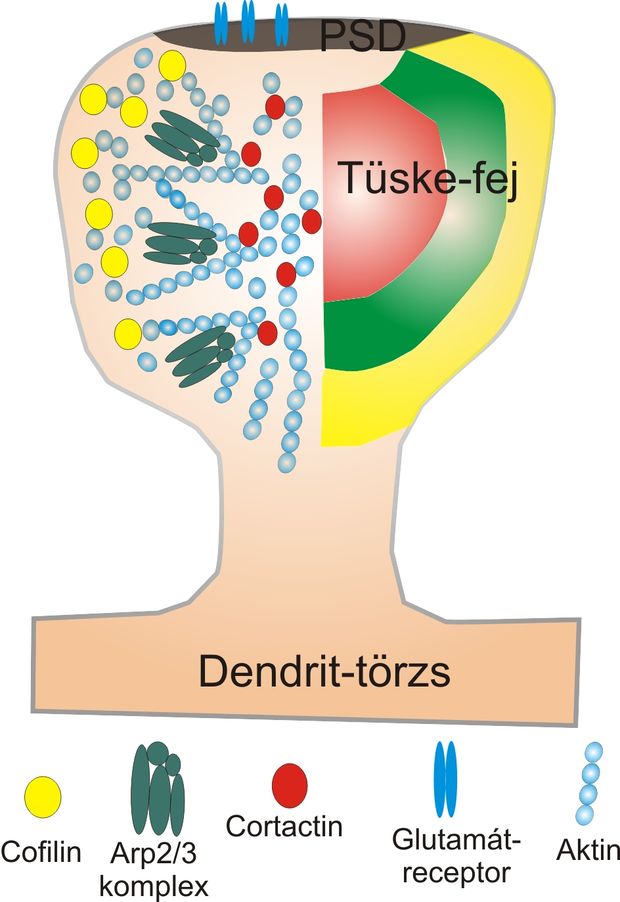
A tüskékben tehát egy igen precíz biokémiai gépezet található, amely a szinaptikus ingerületet nemcsak a dendrit és a sejttest felé közvetíti, de közvetlenül hatással van a tüskevázra is, ezáltal optimalizálja, mintegy hozzáigazítja a jelátvivő „berendezés” morfológiáját az adott rendszerhez. Ez a szinaptikus plaszticitás morfológiai megjelenése is egyben. A tüske-szerkezet megismerése mindenképpen közelebb visz minket az idegi információfeldolgozás megértéséhez, de klinikai jelentősége sem elhanyagolható, hiszen számos neuropszichiátriai és neurodege-nerációs kórkép esetében ismert a tüskék abnormális morfológiája és működése, ami egyértelműen a tüskékben található aktin-váz szabályozásában bekövetkező anomáliákhoz köthetőek.
RÁCZ BENCE LÁSZLÓ
OTKA 83830
PUB-I 111137
2014/39




